]
Мышцы играют решающую роль в поддержании жизни человека и являются самым большим органом, на который приходится 40% массы тела. Мышечная ткань известна своим особым потенциалом к спонтанной регенерации.
Но при серьезных травмах, таких как травмы, полученные в результате дорожно-транспортных происшествий или резекции опухолей, которая приводит к объемной потере мышечной массы (VML), способность мышцы к восстановлению значительно снижается.
Лечение VML в настоящее время включает хирургические вмешательства с использованием аутологичных мышечных трансплантатов или лоскутов с последующей физиотерапией. Но хирургические процедуры обычно приводят к снижению функции мышц, а в некоторых случаях – к полному отказу трансплантата. Следовательно, существует потребность в большем количестве терапевтических возможностей для ускорения восстановления после потери мышечной массы.
Одним из возможных методов повышения функциональной способности поврежденной мышцы является стимулирование регенерации скелетных мышц de novo путем интеграции трансплантированных клеток.
Различные типы клеток, такие как сателлитные клетки или мышечные стволовые клетки, мезенхимальные стволовые клетки и миобласты, используются для лечения потери мышечной массы. Но ограниченное долгосрочное обслуживание, плохая доступность клеток и инвазивные биопсии мышц препятствуют клинической трансляции, когда для получения терапевтических преимуществ могут потребоваться зрелые клетки в количестве от миллионов до миллиардов
.
Другой важной проблемой является управление трехмерной микросредой в месте повреждения, чтобы гарантировать, что трансплантированные клетки правильно дифференцируются в мышечные ткани, имеющие необходимые структуры.
Широкий спектр синтетических и природных биоматериалов был использован для улучшения созревания и выживаемости трансплантированных клеток и, в то же время, рекрутирования хозяйских клеток для регенерации мышц.
Но в развитии тканевых каркасов все еще остаются нерешенные проблемы. Природные каркасы обладают превосходной аффинностью связывания клеток и высоким уровнем распознавания клеток, но обычно не обеспечивают механической прочности в несущих нагрузку тканях или крупных поражениях, которые нуждаются в механической поддержке в течение длительного времени.
С другой стороны, синтетические каркасы предлагают точно спроектированный вариант с регулируемыми физическими и механическими характеристиками, а также индивидуальные биохимические составы и структуры, но этим каркасам обычно препятствует нестандартная интеграция с тканью хозяина и отсутствие набора клеток.
Таким образом, для решения этих проблем группа исследователей из Центра наномедицины Института фундаментальных наук (IBS), расположенного в Сеуле, Южная Корея, университета Йонсей и Массачусетского технологического института (MIT) разработала новый протокол. для восстановления искусственных мышц.
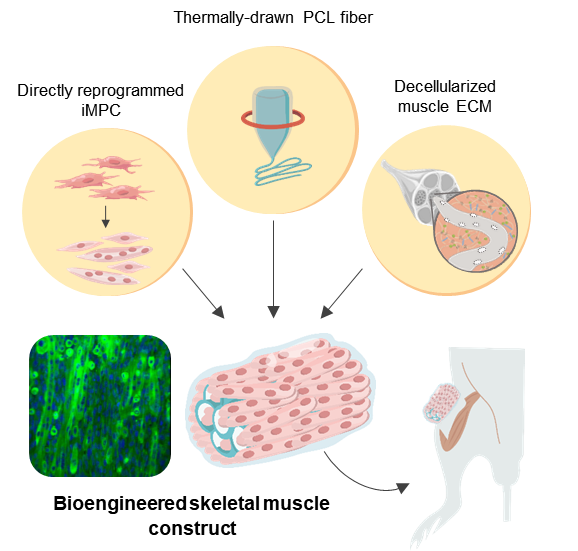
Используя технологию прямого репрограммирования клеток вместе с природно-синтетическим гибридным каркасом, исследователи смогли эффективно лечить VML на мышиной модели.
Прямое перепрограммирование клеток, также называемое прямым преобразованием, является эффективным методом, обеспечивающим эффективное лечение клеток. Это связано с тем, что эта стратегия позволяет быстро генерировать специфичные для пациента клетки-мишени с помощью аутологичных клеток из биопсии ткани.
Фибробласты – это, по сути, клетки, которые часто находятся внутри соединительных тканей, и они играют решающую роль в заживлении ран.
Поскольку фибробласты на самом деле не являются терминально дифференцированными клетками, их можно превратить в индуцированные миогенные клетки-предшественники, или для краткости iMPC, используя множество различных факторов транскрипции. В данном случае этот метод был использован для создания iMPC для моделирования мышечных тканей.
Чтобы обеспечить структурную поддержку пролиферирующих мышечных клеток, команда выбрала поликапролактон (PCL) в качестве идеального материала для создания пористого каркаса из-за его превосходной биосовместимости.
Хотя выщелачивание соли – это метод, который широко используется для производства пористых материалов, он в значительной степени ограничен, когда дело доходит до создания закрытых пористых структур. Следовательно, чтобы устранить это ограничение, исследователи дополнили традиционную технику выщелачивания соли, используя термическую вытяжку, чтобы создать изготовленные на заказ каркасы из волокна PCL.
Этот метод позволил получить высокопроизводительную разработку пористых волокон с контролируемыми размерами, пористостью и жесткостью, что позволяет точно адаптировать каркасы к участкам повреждений. Но каркасы из искусственных волокон PCL не предлагают оптимальных локальных и биохимических механических сигналов, которые имитируют микросреду, специфичную для мышц.
Изготовление гибридного каркаса было завершено путем интеграции гидрогеля децеллюляризованного мышечного внеклеточного матрикса (MEM) в структуру PCL. МЕМ – это натуральный биоматериал, который в настоящее время широко используется для лечения ВМЛ в клинических условиях.
Таким образом, команда считает, что гибридные каркасы, разработанные с использованием MEM, имеют отличный потенциал в клинических применениях.
Полученные таким образом биоинженерные конструкции мышечных волокон проявляли механическую жесткость, аналогичную жесткости мышечных тканей, и демонстрировали улучшенную дифференцировку мышц, а также удлиненное выравнивание мышц in vitro.
Кроме того, когда биоинженерные мышечные конструкции были имплантированы в модель мыши VML, этот метод способствовал регенерации мышц с усилением ангиогенеза и иннервации, а также способствовал функциональному восстановлению поврежденных мышц.
Гибридная мышечная конструкция могла управлять ответами экзогенно добавленных перепрограммированных мышечных клеток и инфильтрирующих популяций клеток-хозяев для усиления функциональной регенерации мышц путем управления дифференцировкой, паракринным эффектом и конструктивным ремоделированием ткани .
Исследователи исследования
« Требуются дальнейшие исследования для выяснения механизмов регенерации мышц с помощью наших гибридных конструкций и расширения возможностей клинической трансляции платформ доставки, инструктирующих клетки », – заключил профессор ЧО Сеунг-Ву из Центра наномедицины IBS и Колледж наук о жизни и биотехнологии Университета Йонсей, возглавлявший новое исследование.
Ссылка на журнал:
Джин. Y., и др. . (2021 год). Функциональная регенерация скелетных мышц с помощью термически вытянутых пористых волокон и перепрограммированных мышечных предшественников при объемной травме мышц. Дополнительные материалы . doi.org/10.1002/adma.202007946.
Источник: https://www.ibs.re.kr/[19459008visible
 Диэнай
Диэнай