Вакцины против тяжелого острого респираторного синдрома коронавируса 2 (SARS-CoV-2) внедряются во всем мире для борьбы с пандемией COVID-19 (коронавирусное заболевание 2019). Множественные вакцины необходимы для борьбы с вариантами эпидемий, а также для преодоления проблем, которые могут быть связаны с текущими вакцинами (например, высокая стоимость или низкая иммуногенность).
В этом контексте группа экспертов проверила иммунные ответы, вызванные гомологичной плазмидой слизистой оболочки, и стратегию гетерологической иммунизации с использованием плазмидной вакцины и модифицированной вакцины Ankara (MVA), экспрессирующей спайк SARS-CoV-2 (S) и нуклеокапсид. (N) антигены. Исследование опубликовано в журнале Vaccines .
Ученые описывают доклиническую разработку 2-дозной гетерологичной вакцины-кандидата против COVID-19 для слизистых оболочек с использованием адъювантной системы QAC (quil-A хитозан). Они показали, что мыши, иммунизированные pQAC / MVA-CoV, эффективно нейтрализовали SARS-CoV-2 дикого типа.
Они обнаружили, что только стратегия гетерологичной интраназальной иммунизации выявляла нейтрализующие антитела против SARS-CoV-2 в сыворотке и бронхоальвеолярном лаваже мышей. Это открытие предполагает, что это защитная вакцина. Они сообщили, что эта стратегия привела к индукции Т-клеточных ответов типа 1 и 17 и полифункциональных Т-клеток, экспрессирующих несколько цитокинов типа 1 (например, IFN-γ, TNFα, IL-2) в легких и селезенках вакцинированных. мыши.
Исследователи обнаружили, что стратегия плазмидной гомологичной вакцины привела к индукции локальных моно- и полифункциональных Т-клеток, секретирующих IFN-γ.
Исследователи отметили, что несколько вакцинных конструкций можно использовать вместе для эффективной иммунизации пациентов.
В исследовании исследователи использовали 1) векторные вакцины (ДНК и вирусные), поскольку плазмиды, кодирующие антигены, могут быть разработаны в течение нескольких дней с помощью современных быстрых и недорогих технологий синтеза генов, и 2) вакцины с вирусным вектором, такие как Модифицированная Штамм Vaccinia Ankara (MVA) – уже налажены высокоэффективные процессы масштабирования производства.
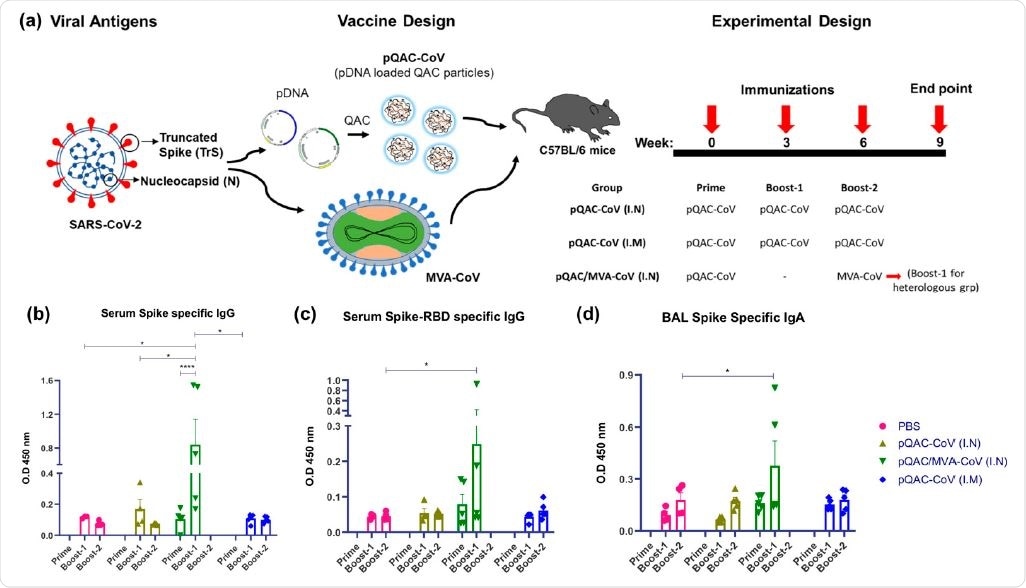
Генерация гуморальных иммунных ответов у мышей C57BL / 6 после иммунизации различными вакцинными конструкциями. (а) Схема вакцины и протокол иммунизации с использованием групп мышей C57BL / 6, вакцинированных 3 дозами pQAC-CoV (I.N) или pQAC-CoV (I.M) с 3-недельным интервалом. Другую группу мышей C57BL / 5 вакцинировали pQAC-CoV (I.N) на неделе 0 с последующей повторной вакцинацией MVA-CoV (I.N) на неделе 6. (b) Титры ELISA S-специфических IgG SARS-CoV-2 в сыворотке мышей, (c) Титры ELISA IgG, специфичных к спайковому рецептору (RBD) SARS-CoV-2, в сыворотке мышей и (d) титры ELISA SARS-CoV-2 S-специфического IgA в бронхоальвеолярном лаваже (БАЛ), значимость (*, p <0,05, ****, p <0,0001) определяли с помощью двухфакторного дисперсионного анализа. Данные показывают среднее значение SEM.
В то время как ДНК-вакцины являются термостабильными (без необходимости логистики холодовой цепи), эти ДНК-конструкции расщепляются in vivo ДНКазами. Это приводит к неэффективному захвату антигенпрезентирующими клетками (APC) и, таким образом, вызывает низкую иммуногенность.
Чтобы преодолеть эту проблему при использовании ДНК-вакцины, исследователи использовали сочлененную систему доставки, такую как хитозан, нагруженный quil-A (QAC). Хитозан – это биоразлагаемый природный полисахарид, который соединяется с ДНК благодаря своему положительному заряду. Quil-A – мощный адъювант с мягкими поверхностно-активными свойствами. Система адъюванта в виде частиц QAC продлевает высвобождение активной плазмиды, экспрессирующей антигены.
В предыдущем исследовании исследователи показали, что 2-дозная инкапсулированная в ЧАС плазмидная ДНК (pQAC), кодирующая ген нуклеокапсида (N) против птичьего коронавируса, вызвала устойчивые Т-клеточные ответы, не дополняя гуморальные ответы.
С этим наблюдением исследователи продолжили разработку гетерологичной стратегии с прайм-инкапсулированной плазмидной ДНК (pQAC), инкапсулированной в QAC, за которой следует усиление MVA, ожидая более широкого иммунного ответа. И плазмиды pQAC (pQAC-CoV), и вектор MVA (MVA-CoV) были разработаны для экспрессии антигенов S (спайк) и N (нуклеокапсид), кодируемых SARS-CoV-2 с ранней фазы COVID-19. пандемия.
Исследователи наблюдали, что pQAC / MVA-CoV индуцировал как системные, так и локальные нейтрализующие антитела у мышей (при иммунизации интраназально), дополняемые локализованными клеточными ответами Th17. Более того, они сообщили, что мыши, вакцинированные только плазмидными векторами (pQAC-CoV), генерировали значимые клеточные ответы типа 1 и типа 17 (Tc17 или Th17). Они подробно обсудили местный и системный иммунный ответ в статье.
Основываясь на опубликованных исследованиях уровней антител против SARS, В-клеток памяти и Т-клеток, исследователи отметили, что вакцины, полагающиеся исключительно на нейтрализующий ответ антител (который снижается в течение 3 месяцев после выздоровления), могут не обеспечивают долгосрочную защиту от SARS-CoV-2 и других коронавирусов.
Помня об этом, исследователи изучили вакцины против SARS-CoV-2, которые могут вызывать как гуморальный, так и клеточный иммунный ответ. Ясно, что это может обеспечить более длительный защитный иммунный ответ, чем вакцины, ориентированные только на нейтрализацию антител.
«В настоящее время большинство экспериментальных ДНК-вакцин подходят только для внутримышечного введения, ограничивая иммунитет слизистой оболочки, критически необходимый для уменьшения вирусной инфекции».
В связи с новыми инфекционными заболеваниями всегда есть потребность в новых вакцинах. Вакцины, разработанные с использованием хорошо стандартизированных процессов, позволяют использовать их во время пандемии, такой как COVID-19. Настраиваемые конструкции вакцины предлагают очень гибкие программы вакцинации. Поскольку гетерологичная вакцинация вызвала как местные, так и системные гуморальные и Т-клеточные иммунные ответы, исследователи предположили, что стратегия гетерологичной вакцины могла бы лучше обеспечивать стерилизующий иммунитет против SARS-CoV-2.
Ссылка в журнале:
- Chandrasekar, S.S .; Phanse, Y .; Hildebrand, R.E .; Ханафи, М .; Wu, C.-W .; Hansen, C.H .; Osorio, J.E .; Суреш, М .; Талаат А.М. Локальные и системные иммунные ответы против SARS-CoV-2 после иммунизации слизистой оболочки. Вакцины 2021 9 132. https://doi.org/10.3390/vaccines9020132, https://www.mdpi.com/2076-393X / 9/2/132
 Диэнай
Диэнай