Нозокомиальные или медицинские инфекции (HAI) – это инфекции, которые возникают в медицинских учреждениях. Эти инфекции могут вызывать значительную заболеваемость и смертность пациентов.
Известно также, что HAI несут значительное финансовое бремя для систем здравоохранения. Возникновение пандемии коронавирусного заболевания 2019 (COVID-19) увеличило это бремя для медицинских учреждений по всему миру.
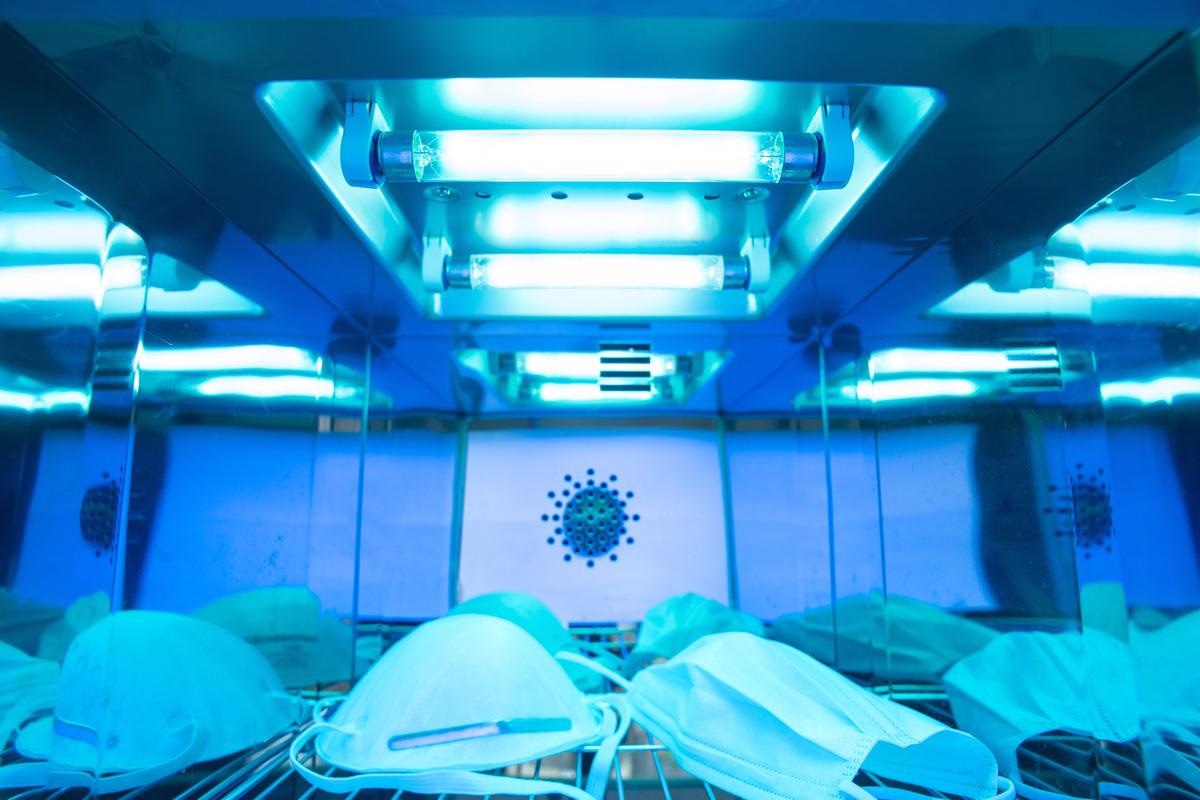
Исследование: Выявлено: как ультрафиолетовая дезинфекция может предотвратить внутрибольничную передачу COVID-19 и других инфекционных заболеваний. Изображение предоставлено: Нор Гал / Shutterstock.com
Справочная информация
Наиболее распространенными известными внутрибольничными патогенами являются вирусы или бактерии. Хотя существует множество антибиотиков, доступных для использования, устойчивость к антибиотикам, а также неспособность этих соединений лечить вирусные инфекции ограничивают применимость этого варианта лечения.
Таким образом, эти патогены способны выживать на поверхности в течение многих лет и могут передаваться людям в медицинских учреждениях. Наибольший риск для системы здравоохранения представляют заболевания, которые трудно поддаются лечению; поэтому профилактика заболеваний, вызываемых этими патогенами, имеет большое значение.
Эффективная очистка поверхностей считается важной для предотвращения передачи патогенов. Однако несколько исследований показали, что менее 50% поверхностей в палатах пациентов очищаются эффективно, что позволяет этим комнатам стать резервуарами окружающей среды, которые могут заразить последующих пациентов.
Необходимо рассмотреть возможность усиленной очистки окружающей среды, чтобы предотвратить передачу HAI. Ручная очистка недостаточна; поэтому необходимо рассмотреть новые стратегии дезинфекции для предотвращения болезней, вызываемых патогенами, особенно тех, которые трудно лечить.
В новой обзорной статье, опубликованной в Applied Microbiology определяется роль ультрафиолетовой (УФ) дезинфекции для внутрибольничной передачи COVID-19 и других инфекционных заболеваний.
Механизм вирусной мутации
Мутации вирусов – важный фактор, способствующий распространению болезней. Мутантные варианты вируса не распознаются иммунной системой, и варианты лечения также ограничены. Кроме того, антигенный сдвиг и дрейф могут снизить эффективность вакцин.
Мутировавший вирус после сдвига с наибольшей вероятностью вызовет пандемию, поскольку у населения нет иммунитета к нему. Это явление наблюдалось в случае коронавируса тяжелого острого респираторного синдрома (SARS-CoV-1) и SARS-CoV-2. Хотя оба этих вируса используют один и тот же рецептор ангиотензинпревращающего фермента 2 (ACE2) для проникновения в клетки-хозяева, проникновение более эффективно в случае SARS-CoV-2.
Аналогичное явление наблюдается в случае мутировавшего дельта-варианта SARS-CoV-2. Вариант Delta может распространяться в три раза быстрее, чем исходный штамм, а также может подавлять иммунную систему хозяина.
Хотя современные вакцины против COVID-19 эффективны против варианта Дельта, остается вероятность появления новых вакцинно-устойчивых штаммов. Следовательно, необходимо применять невакцинальные стратегии, чтобы предотвратить распространение болезни.
Механизм устойчивости к антибиотикам
Рост устойчивости к антибиотикам может привести к будущей пандемии, в то время как многие ученые считают, что мы уже находимся в условиях этой «тихой пандемии». Устойчивость к антибиотикам может сделать несколько повседневных процедур небезопасными.
Бактерии, несмотря на то, что они одноклеточные организмы, выжили более трех миллиардов лет благодаря своей приспособляемости и генетической пластичности. Эти механизмы также помогают бактериям приобретать устойчивость к антибиотикам, детергентам и дезинфицирующим средствам.
Грамотрицательные бактерии более устойчивы к дезинфицирующим средствам из-за их внешней мембраны. Следовательно, эти бактерии могут сохраняться в больничной среде и вызывать болезни у пациентов. Необходимы дальнейшие исследования для определения лучших стратегий контроля, которые могут предотвратить инфекции организмов с множественной лекарственной устойчивостью (MDRO).
Передача заболевания в медицинских учреждениях
Понимание путей передачи болезней может иметь важное значение для предотвращения передачи болезней и будущих инфекций. Три фактора передачи патогена включают восприимчивого хозяина, вирулентного патогена и благоприятную окружающую среду.
Факторы хозяина труднее всего регулировать, так как многие пациенты с сопутствующими заболеваниями попадают в больницы. Вакцинация считается наиболее актуальной в случае COVID-19; однако больницы не могут дискриминировать невакцинированных пациентов. Кроме того, для многих инфекционных патогенов нет доступных вакцин. Таким образом, наиболее важными факторами борьбы с инфекцией являются окружающая среда и патоген.
Четыре основных пути передачи болезни включают переносчиками, транспортными средствами, контактными и воздушными путями. Контактная передача включает физический контакт и прямую передачу патогенов между людьми.
Транспортная передача – это косвенная передача инфекционного агента от резервуара к хозяину. Наиболее распространенными транспортными средствами в условиях больницы могут быть зараженные катетеры, хирургические инструменты или предметы в палатах пациентов.
Передача через воздух происходит, когда патогены взвешиваются в воздухе и вызывают заболевание, попадая в дыхательную систему. Наконец, переносчик – это распространение болезней животными.
Несмотря на то, что существует множество путей передачи инфекции в больницу, появление COVID-19 подчеркнуло важность дезинфекции окружающей среды. Использование средств индивидуальной защиты (СИЗ) считается наиболее важным методом предотвращения передачи вируса, за которым следует мытье рук и поддержание социального дистанцирования. Эти методы не эффективны сами по себе; поэтому было разработано несколько вакцин для снижения передачи COVID-19.
Текущий подход к инфекционному контролю
Первым подходом к предотвращению передачи патогенов является соблюдение гигиены рук. Практика гигиены рук привела к снижению числа инфекций, вызываемых МДРО.
Однако одной лишь гигиены рук недостаточно, поскольку передача патогенов транспортными средствами часто требует очистки окружающей среды. Раствор моющего средства используется для очистки клинических поверхностей, в то время как дезинфицирующее средство используется для очистки поверхностей повышенного риска.
Кроме того, воздушную трансмиссию можно ограничить за счет использования воздушного фильтра. Сюда входят защитные маски для лица, высокоэффективная фильтрация воздуха, поглощающая частицы (HEPA), и процедуры вентиляции.
Во время пандемии COVID-19 ношение масок было обычным делом как среди медицинских работников, так и среди простых людей. Однако по-прежнему существует потребность в дополнительных стратегиях дезинфекции для дальнейшего снижения передачи патогенов, таких как SARS-CoV-2. Во время пандемии COVID-19 УФ-дезинфекция воздуха и поверхностей приобрела популярность во всем мире.
УФ бактерицидное облучение
Ультрафиолетовое бактерицидное облучение использует ультрафиолетовые лучи в диапазоне длин волн от 200 до 320 нанометров (нм). УФА находится вне этого диапазона и не считается бактерицидным. Наиболее известным бактерицидным УФ-излучением является УФ-С, которое используется во многих коммерческих системах.
История УФ-дезинфекции
Первое сообщение о бактерицидных свойствах света было опубликовано в 1877 году Даунсом и Блант. После этого Маршал Уорд показал, что фиолетовый конец светового спектра может вызывать инактивацию бактерий в 1892 году.
В 1903 году Нильс Финсен получил Нобелевскую премию по физиологии и медицине за лечение заболеваний, связанных с туберкулезом, с помощью концентрированного светового излучения. Бактерицидный спектр был разработан Гейтсом в 1930 году. Однако в это время был также открыт пенициллин, который сместил фокус с УФ-света.
В 1988 году Болтон показал, что УФ-свет может действовать как дезинфицирующее средство широкого спектра действия, способное инактивировать почти все бактерии, вирусы и простейшие. Сегодня ультрафиолетовое излучение широко используется в качестве дезинфицирующего средства, потому что это не содержащий химикатов процесс и довольно эффективен против химически устойчивых организмов.
Механизм УФ-микробной инактивации
УФ-свет вызывает инактивацию микробов после его поглощения патогенным генетическим материалом. УФ-свет сильно поглощается двойными связями тимин-цистеин в пиримидиновых основаниях, что вызывает разрыв водородных связей, что в дальнейшем позволяет пиримидиновому основанию реагировать с соседними молекулами. УФ-излучение также может приводить к сшиванию несмежных тиминов или между цитозином и гуанином.
УФ-излучение быстро нацелено на дезоксирибонуклеиновую кислоту (ДНК). Фактически, UVB вызывает от 50 до 100 двухцепочечных разрывов в каждой клетке, тогда как UVC вызывает 50 000 димеров пиримидина на клетку.
Однако эти повреждения могут быть восстановлены с помощью механизмов репарации ДНК клетки. Ультрафиолетовый свет может также вызывать повреждение белковых капсул некоторых вирусов, изменять вторичные структуры белков, вызывать разворачивание или агрегацию белков и обнажать гидрофобные области.
Клиническое применение УФ-дезинфекции
Хотя моющие средства обычно используются для очистки поверхностей, они не инактивируют устойчивый к антибиотикам генетический материал. Эти генетические материалы впоследствии сохраняются в окружающей среде и могут передаваться соседним бактериям посредством горизонтального переноса генов. Примечательно, что моющие и дезинфицирующие средства также не влияют на болезнетворные микроорганизмы, переносимые по воздуху.
Однако использование УФ-дезинфекции в больницах пока не очень распространено, так как оно не подходит для определенных медицинских учреждений, таких как отделения неотложной помощи. Наиболее подходящее использование ультрафиолетового излучения в больницах – это очистка зон повышенного риска.
УФ-системы для верхних помещений можно использовать в жилых помещениях, если они соответствующим образом спроектированы для ограничения УФ-излучения в нижнем помещении. Закрытые воздушные фильтры UVC и автоматизированные роботы для УФ-дезинфекции можно использовать в любом месте больницы. УФ-дезинфекция – это дополнительная стратегия очистки, которую необходимо использовать наряду с ручной очисткой; однако она не должна заменять ручную очистку.
При выборе системы УФ-дезинфекции поверхностей в больнице необходимо соблюдать определенные критерии, такие как экономичность, простота использования и транспортировка. Кроме того, эти УФ-устройства должны быть оснащены множеством функций безопасности в сочетании с принятием определенных мер безопасности, предотвращающих утечку света в окружающую среду. Кроме того, УФ-устройство необходимо регулярно чистить и контролировать.
УФС-активность против клинических патогенов
В нескольких исследованиях сообщалось, что UVC способен инактивировать высокие вирусные нагрузки как SARS-CoV-1, так и SARS-CoV-2. Таким образом, UVC довольно эффективно снижает передачу SARS-CoV-2. Также было обнаружено, что УФ-излучение инактивирует MDRO и другие устойчивые к антибиотикам бактерии.
Передача возбудителя воздушным путем
Точная идентификация путей передачи SARS-CoV-2 может иметь значение для его распространения в больницах и населенных пунктах. Несколько исследований предоставляют четкие доказательства того, что передача SARS-CoV-2 происходит по воздуху. SARS-CoV-2 также может передаваться с фекальными аэрозолями через высушенные ванны и дренажные системы в полу.
УФ-дезинфекция воздуха
Обеззараживание воздуха и поверхностей можно проводить с помощью УФ-роботов; однако из-за их мутагенного действия их нельзя использовать в жилых помещениях.
HEPA-фильтрация обычно используется для улавливания и ограничения рециркуляции частиц в воздухе. Однако эффективность фильтров HEPA ограничена, поскольку они не могут улавливать частицы размером менее 0,3 микрометра (мкм), которые включают вирусы, летучие органические соединения (канцерогенные) и некоторые белки. Диаметр SARS-CoV-2 оценивается в диапазоне от 60 до 140 нм, что значительно ниже ловушки фильтра HEPA.
В новейших системах фильтрации воздуха используется гибрид физических и биологических систем. Новые технологии используют фильтры HEPA вместе с UVC для дезинфекции частиц. Это улучшает процесс дезинфекции и предотвращает передачу патогенов.
Верхние УФ комнатные системы
УФ-системы в верхней комнате создают бактерицидную зону УФ-света, расположенную в самой верхней части комнаты. Рабочий механизм, лежащий в основе верхних комнатных ультрафиолетовых систем, заключается в максимальном воздействии ультрафиолетового излучения на верхний воздух помещения при минимальном воздействии на людей, находящихся внизу. Эти УФ-системы для верхних помещений полезны для сред с повышенным риском, таких как операционные или залы ожидания.
Некоторые из соображений, касающихся УФ-систем в верхних помещениях, включают скорость воздухообмена, дозу УФ-излучения, время воздействия УФ-излучения, высоту потолка, влажность, температуру, воздействие медицинского оборудования и техническое обслуживание ламп.
Передача патогенов через поверхность
Патогены ежедневно выделяются с кожи пациентов и медицинских работников, из дыхательных капель или аэрозолей, которые оседают на поверхности и образуют фомиты. Эти патогены способны годами выживать на поверхности.
Недавно было обнаружено, что SARS-CoV-2 сохраняет жизнеспособность на непористых поверхностях в течение как минимум 28 дней и 21 день на материале маски N95. Патогены часто остаются на этих поверхностях из-за неэффективной ручной очистки.
Однако риск передачи SARS-CoV-2 через воздействие на загрязненные поверхности низок по сравнению с прямой и воздушной передачей. Тем не менее, важно понимать роль поверхностей окружающей среды в передаче болезней.
Респираторные капли и частицы SARS-CoV-2 могут оседать на поверхностях, где они остаются жизнеспособными в течение семи дней. Поэтому гигиена рук и дезинфекция поверхностей чрезвычайно эффективны для предотвращения передачи инфекции через поверхность.
УФ-дезинфекция непористых поверхностей
В настоящее время на рынке доступно несколько устройств, использующих УФ-технологию для использования в медицинских учреждениях. С этой целью два известных устройства включают импульсные ксеноновые УФ-излучатели и стационарные УФ-излучатели. Эти технологии могут эффективно снизить передачу HAI, включая MDRO, метициллин-резистентный Staphylococcus aureus (MRSA) и ванкомицин-устойчивый энтерококк (VRE).
УФ-дезинфекция пористых материалов
Одним из основных последствий пандемии COVID-19 стала глобальная нехватка СИЗ. Одноразовые СИЗ, такие как хирургические маски, респираторы N95 и одноразовые халаты, использовались повторно в течение нескольких дней, что подвергало медицинских работников высокому риску заражения.
В это время для преодоления дефицита была проведена дезинфекция одноразовых СИЗ УФ-фильтром. Многие исследования показали, что ультрафиолетовое излучение способно инактивировать вирионы SARS-CoV-2, которые были захвачены пористыми материалами, особенно покрытиями лица. Использование ультрафиолетового излучения для обеззараживания СИЗ не только снизило риск заражения, но также снизило затраты и объем медицинских отходов.
Исследования также показали, что УФ-излучение способно снизить микробную нагрузку на загрязненные маски при сохранении целостности материала маски. УФ-дезинфекция этих материалов должна соответствовать определенным критериям, например, УФ-излучение должно находиться в непосредственном контакте с материалом, а целевой материал не должен быть покрыт другими материалами.
Заключение
В текущем обзоре исследуется передача заболеваний в медицинских учреждениях и указывается, что дезинфекция окружающей среды является ключевым фактором предотвращения передачи болезней. УФ-дезинфекция очень эффективна; однако он не заменяет ручную очистку поверхностей, а должен дополнять эти процедуры.
Что касается текущей пандемии, УФС оказался достаточно эффективным в снижении передачи SARS-CoV-2. Тем не менее, необходимы дальнейшие исследования для определения долгосрочных преимуществ УФ-дезинфекции, а также снижения показателей HAI при использовании этой технологии для ее регулярного использования в клинических условиях.
 Диэнай
Диэнай