Пандемия COVID-19 связана с потенциально смертельным легочным заболеванием, вызванным тяжелым острым респираторным синдромом, вызванным коронавирусом 2 (SARS-CoV-2).
<img alt=" Системное распространение лентивирусов, псевдотипированных по белку Spike (Spp) и гликопротеина вируса везикулярного стоматита (VSV-G), у мышей. ("height =" 1223 "src =" https://d2jx2rerrg6sh3.cloudfront.net/image-handler/picture/2020/12/Captureada.jpg "title =" Системное распространение псевдотипированного белком Spike (Spp) и везикулярного стоматита вирусный гликопротеин (VSV-G) лентивирусы у мышей. ("width =" 1877 "/>
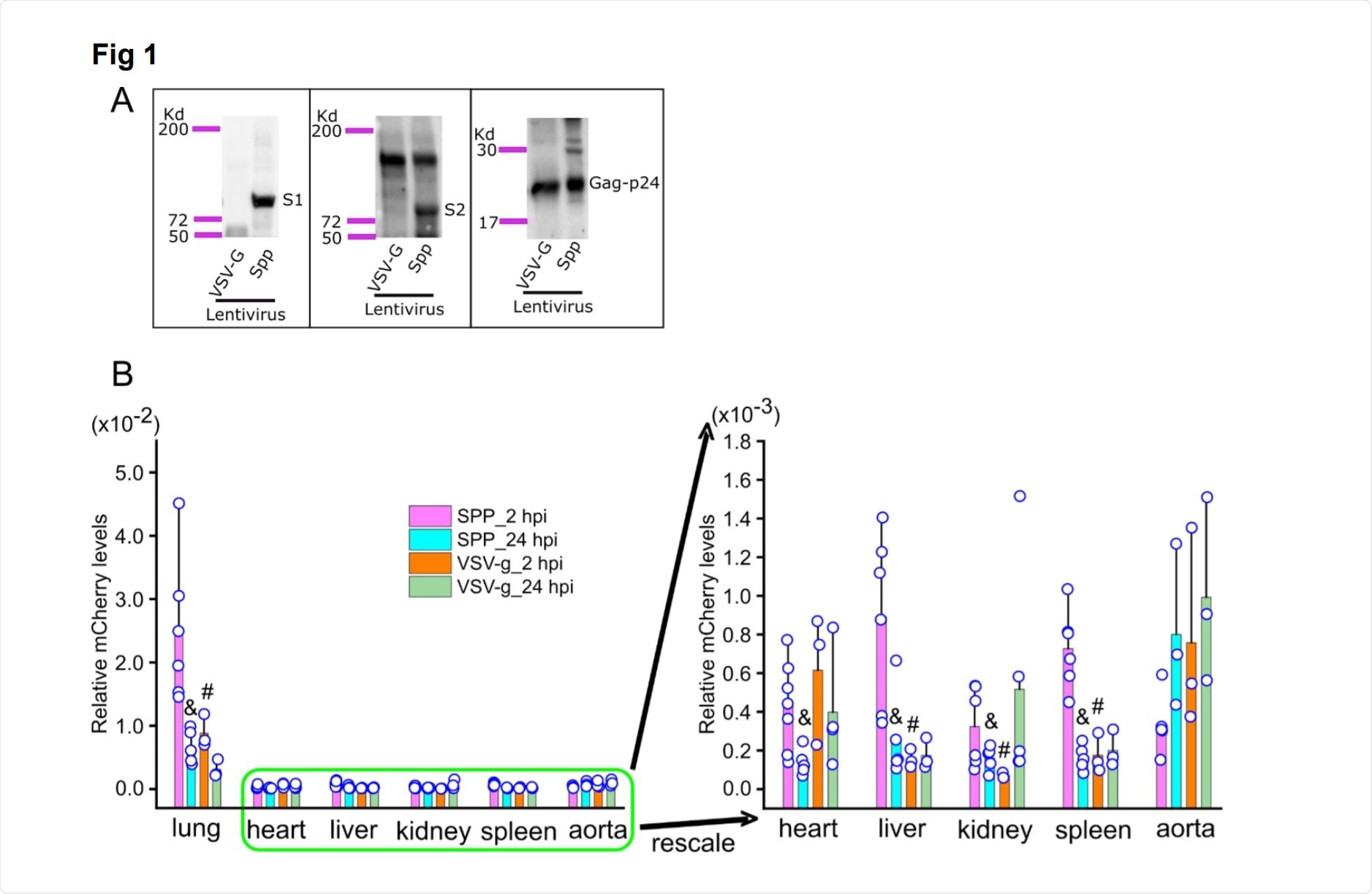
Системное распространение лентивирусов, псевдотипированных по белку Spike (Spp) и гликопротеина вируса везикулярного стоматита (VSV-G), у мышей. Изображение предоставлено: https://www.biorxiv.org/content/10.1101/2020.12.07.414706v1.full.pdf[19459018impression[19459014provided
)
Интересный новый препринт, появившийся на сервере bioRxiv * в декабре 2020 года, показывает, что вирусный спайк-белок, который входит в число его иммунодоминантных антигенов, сам по себе достаточен, чтобы вызвать активацию макрофагов в легочной ткани и вызвать острую воспаление.
Белок вирусного спайка опосредует вход
SARS-CoV-2 представляет собой оболочечный РНК-вирус с большим геномом, поверхность которого усеяна шипами, образованными гликопротеином. Этот шип или S-антиген состоит из двух субъединиц, S1 и S2, и существует в форме гомотримеров.
Субъединицы S1 и S2 опосредуют прикрепление к рецептору клетки-хозяина, ангиотензинпревращающему ферменту 2 (ACE2) и слияние вирусной мембраны, соответственно, позволяя вирусу проникать в клетку-хозяина и реплицироваться. Этот процесс зависит от присутствия фурина или TMPRSS2, обеих протеаз хозяина, которые могут расщеплять белок S на его компоненты.
Несмотря на низкие уровни ACE2 в легочной ткани, он коэкспрессируется с TMPRSS2 в альвеолярных клетках 2 типа и бокаловидных клетках носового эпителия. Другой рецептор входа был недавно идентифицирован, нейропилин 1 (NRP1), по-видимому, с использованием ACE2-независимого механизма входа.
Воспалительный патогенез тяжелой формы COVID-19
COVID-19, как известно, более серьезен и опасен для людей с уже существующими заболеваниями, такими как гипертония, диабет и другие сердечно-сосудистые заболевания. Считается, что основной причиной тяжелого / критического заболевания является чрезмерное воспаление, вызванное вирусом.
Настоящее исследование исследует единственный аспект механизма вирусного заболевания, а именно взаимодействие макрофагов и спайк-макрофагов и, как следствие, острое воспаление легких.
Исследователи использовали спайк-экспрессирующий псевдовирус, который вводили генно-инженерным мышам. Использование псевдовирусов устраняет необходимость в лабораториях с уровнем биобезопасности 3, что было бы необходимо для исследований самого SARS-CoV-2.
Спайковый белок наиболее сильно влияет на легкие
При аутопсии через 1 и 2 часа после заражения легкие показали присутствие вируса, но наивысшее значение при 2 hpi. Когда псевдовирус сравнивали с другим вирусом, лентивирусом VSV-G, используемым в качестве контроля, было обнаружено, что первый вызывает трехкратное повышение вирусной нагрузки в легких.
Кроме того, вирусная нагрузка в легких была в 27 раз больше, чем в печени, в 33 раза больше, чем в селезенке, в 55 раз больше, чем в сердце, и в 74 раза больше, чем в почках. Вирусная нагрузка во всех органах значительно снизилась во всех тканях через 24 часа на дюйм
Однако, в то время как легкие не показали явных изменений на 2 hpi, множественные поражения были обнаружены на 24 hpi с воспалительными инфильтратами, утолщением альвеолярных перегородок и фибринопротеидным экссудатом.
Напротив, контрольная группа показала только легкое воспаление. Таким образом, псевдовирусная инфекция вызвала поражения, очень похожие на те, которые наблюдаются при тяжелой форме COVID-19, что указывает на то, что спайковый белок ответственен за острую пневмонию, наблюдаемую у этих пациентов.
Поступление вирусов и метаболизм липидов
Во-вторых, исследователи исследовали клеточный тропизм псевдовируса. Они обнаружили, что большинство инфицированных клеток несут маркер рецептора липопротеинов низкой плотности (LDLr), и действительно, около 84% этих клеток были инфицированы.
Что касается маркеров макрофагов CD68 и MRC1, около 10% инфицированных клеток отображали прежний маркер, что в целом составляет ~ 38% этих макрофагов. Макрофаги MRC1 оказались мало восприимчивыми к псевдовирусу.
Интенсивное воспаление легких
В-третьих, они обнаружили, что легкие вырабатывают набор воспалительных маркеров в ответ на псевдовирусную инфекцию, а именно IL 6, IL10, CD80 и PPAR-γ.
Чтобы проверить способность белка-шипа модулировать иммунную функцию, исследователи инфицировали RAW-клетки. Они обнаружили, что при 2 hpi профиль транскрипции сдвигается в сторону более высокой экспрессии этих цитокинов по сравнению с контрольными клетками или клетками, инфицированными VSV-G, и уровни этих мРНК продолжают расти при 16 hpi. При воздействии одной плазмиды ДНК, кодирующей спайк, эти клетки продолжали демонстрировать повышение экспрессии белка S.
Каковы последствия?
Исследователи изучили влияние внутривенной инъекции вируса в отличие от распространенного интраназального пути заражения. В защиту этой практики они указывают, что вирус быстро распространяется из дыхательной системы в кровь и во многие органы при прогрессирующем и запущенном заболевании, и это действительно определяет серьезность симптомов. Результаты этого исследования показывают, как виремия способствует прогрессированию болезни на подходящей животной модели.
Таким образом, это исследование показывает, что белок-спайк SARS-CoV-2 является патогенным как для изолированных клеток, так и для подходящей модели на животных. Это также подтверждает полезность лентивируса, экспрессирующего спайк, для изучения восприимчивости различных типов клеток к инфекции и повреждению, опосредованным белком S.
Исследователи показывают, что вирус проявляет высокий тропизм альвеолярных клеток, вызывая острую пневмонию, опосредованную или, по крайней мере, усиленную присутствием белка-шипа. Он демонстрирует тропизм, проявляемый экспрессирующими LDLr клетками легких типа II и макрофагами в легких, которые также несут рецептор ACE2.
Однако у мышей, вероятно, будут задействованы другие рецепторы, поскольку их рецепторы ACE2 имеют более низкое сродство к белку шипа по сравнению с человеческим ACE2. Это может быть дополнительно изучено с помощью этого псевдовируса.
Воспалительные изменения, наблюдаемые в этой модели, не связаны с репликацией вируса, поскольку этот псевдовирус неспособен к репликации. Вместо этого он воспроизводит часть болезненного процесса в инфицированном легком в форме усиленного воспаления и активации множества воспалительных маркеров после заражения псевдовирусом, но не контрольным вирусом.
Соответствующие изменения в клетках RAW подтверждают роль, которую играет спайковый белок в индукции воспаления макрофагов, и в этой области необходимы дальнейшие исследования.
Основное вовлечение клеток, несущих ЛПНП, также связывает острое воспаление легких и заболевание с изменениями липидного обмена. Белок-шип может связывать липиды в связывающем кармане. Потребуются исследования, чтобы установить, участвуют ли эти рецепторы также в проникновении вируса.
* Важное примечание
bioRxiv публикует предварительные научные отчеты, которые не рецензируются и, следовательно, не должны рассматриваться как окончательные, руководящие клинической практикой / поведением, связанным со здоровьем, или рассматриваться как установленная информация.
 Диэнай
Диэнай