С появлением COVID-19 (коронавирусная болезнь 2019) исследователи внимательно изучали сложное взаимодействие между инфекцией, вызванной тяжелым острым респираторным синдромом, вызванной коронавирусом 2 (SARS-CoV-2), иммунной системой человека и болезнью COVID-19. серьезность.
Сигнальные белки, называемые цитокинами, каскадно повышаются до опасного уровня, что приводит к «цитокиновому шторму», который повреждает клетки тела (самих себя). Высокие уровни внутрисосудистых внеклеточных ловушек нейтрофилов (NET) или остатков воспалительных клеток усиливают тромбоз. Все это синергетически приводит к макрососудистому и микрососудистому тромбозу во время инфекции SARS-CoV-2.
Хотя активация эндотелиальных клеток идентифицирована как часть тромбо-воспалительного шторма COVID-19, вышестоящие медиаторы этой активации неизвестны. В недавней препринте medRxiv * исследователи впервые сообщают, что сыворотка от пациентов с COVID-19, содержащая циркулирующие антифосфолипидные антитела, активирует эндотелиальные клетки для экспрессии молекул поверхностной адгезии (а именно E-селектина, VCAM- 1 и ICAM-1). Эти молекулы поверхностной адгезии известны своей ролью в тромбозах.
Междисциплинарная группа под руководством доктора Джейсона С. Найта и доктора Йогендры Канти обнаружила, что, по крайней мере, для части образцов сыворотки, эту активацию можно полностью уменьшить, истощив образцы иммуноглобулина G (IgG).
«Протромботические aPL-Abs прочно связаны с этими фенотипами, что свидетельствует о новом механизме, с помощью которого эти аутоантитела могут поддерживать тромбовоспалительное действие при COVID-19».
Ученые, изучающие COVID-19, все чаще подчеркивают роль аутоантител, которые взаимодействуют с клеточными поверхностями, активируют эндотелиальные клетки, тромбоциты и нейтрофилы, склоняя поверхность раздела кровь-эндотелий к тромбозу. Ранее эта группа обнаружила, что фракции COVID-19 IgG, обогащенные антифосфолипидными антителами (aPL Abs), потенциально активируют нейтрофилы in vitro а также усиливают тромбоз при введении мышам.
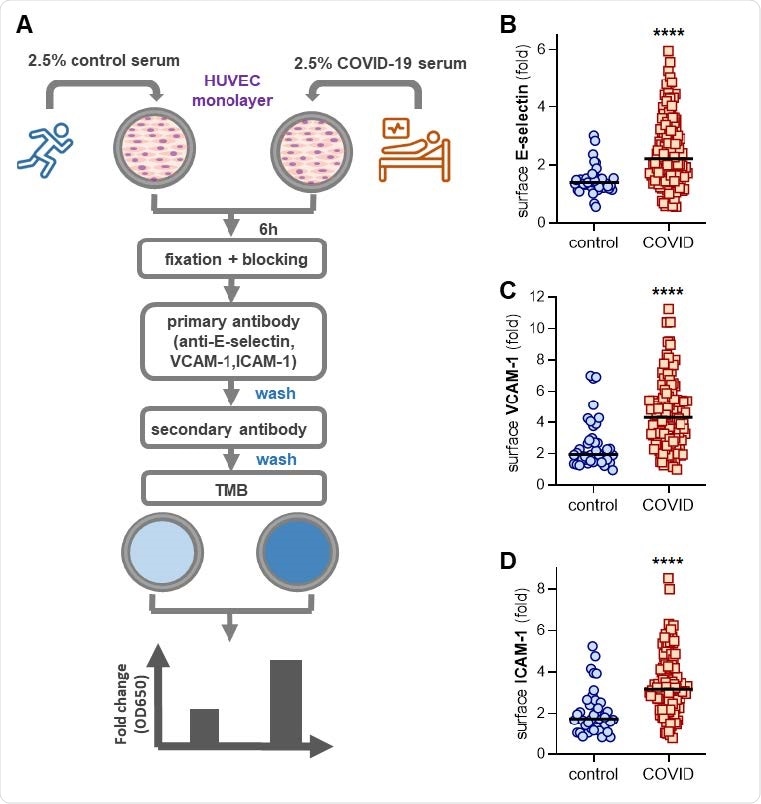
Активация эндотелиальных клеток пупочной вены человека (HUVEC) контрольной сывороткой или сывороткой COVID-19. (A) Схема рабочего процесса для ELISA в ячейке. HUVEC культивировали в течение 6 часов с сывороткой либо здоровой контрольной группы (собранной до пандемии), либо пациентов, госпитализированных с COVID-19. Затем клетки фиксировали и количественно определяли поверхностную экспрессию E-селектина (B), VCAM-1 (C) или ICAM-1 (D). Медианные значения обозначены горизонтальными линиями. Группы анализировали с помощью теста Манна-Уитни; **** p <0,0001.
В настоящем исследовании исследователи демонстрируют свою гипотезу о том, что циркулирующие факторы, такие как остатки нейтрофилов внеклеточной ловушки (NET), D-димер или C-реактивный белок, могут предсказать образцы сыворотки COVID-19 (n = 118), которые больше всего устойчиво активированные культивируемые эндотелиальные клетки.
Как и ожидалось, они обнаружили корреляцию между сывороточными остатками NET (внеклеточная ДНК, комплексы миелопероксидаза-ДНК, цитруллинированный гистон H3) и повышением регуляции поверхностного E-селектина, VCAM-1 и ICAM-1 на эндотелиальных клетках. Однако интересно, что они также обнаружили, что наличие циркулирующих антифосфолипидных антител (в частности, антикардиолипиновых IgG и IgM и антифосфатидилсерин / протромбиновых (анти-PS / PT) IgG и IgM) в качестве маркеров COVID-19 сыворотки с сильной активацией эндотелиальных клеток – потенциал.
Когорта исследования включала 118 пациентов, госпитализированных с COVID-19 средней и тяжелой степени тяжести в академической больнице. Сыворотку этих пациентов с COVID-19 разводили в культуральной среде, а затем добавляли к эндотелиальным клеткам пупочной вены человека раннего пассажа (HUVEC). Любую экспрессию маркеров активации поверхности определяли через 6 часов с помощью специального внутриклеточного ELISA. В качестве контроля образцы сыворотки были взяты у 40 здоровых людей.
Исследователи обнаружили, что образцы COVID-19 запускали фенотип активированных эндотелиальных клеток, о чем свидетельствует повышенная поверхностная экспрессия молекул адгезии лейкоцитов E-selectin, VCAM-1 и ICAM-1.
В поисках медиаторов, активирующих эндотелиальные клетки, исследователи измерили NET в сыворотке и общие маркеры тромбовоспалительного процесса: C-реактивный белок, D-димер и кальпротектин нейтрофилов. Их результаты демонстрируют умеренную корреляцию между НЭО, тромбовоспалением и способностью сыворотки COVID-19 активировать эндотелиальные клетки.
В этом исследовании исследователи обнаружили сильную корреляцию между всеми четырьмя антителами (изотипы IgG и IgM двух типов aPL Abs (антикардиолипин и анти-PS / PT) и тремя маркерами активации эндотелиальных клеток (E-селектин, VCAM-1 и ICAM-1), что указывает на их роль в активации эндотелиальных клеток.
Таким образом, эти данные показывают, что сыворотка COVID-19 содержит факторы, способные активировать эндотелиальные клетки. Исследователи цитируют и обсуждают многочисленные недавние сообщения об аутоантителах у пациентов с COVID-19 и очевидную связь с тяжестью заболевания.
«Взятые вместе, эти данные предполагают патологическую роль аутоантител в COVID-19 с различным влиянием на иммунную функцию, тромбоз и вероятные клинические исходы».
Одним из возможных клинических результатов исследования, предложенного исследователями, является рассмотрение вопроса о том, следует ли проводить скрининг пациентов с COVID-19 от умеренной до тяжелой степени на наличие АФЛ-антител для оценки риска тромбоза и прогрессирования респираторной недостаточности. Впоследствии таким пациентам могут быть полезны альтернативные стратегии лечения.
Важно отметить, что эти результаты этого исследования также предполагают другие потенциальные методы лечения, включая опосредованное моноклональными антителами истощение плазмобластов, специфическое ингибирование В-клеток, реагирующих с фосфолипидами и фосфолипид-связывающими белками, терапию, стабилизирующую эндотелиальные клетки, и манипулирование патогенными факторами. -Гликозилирование или афукозилирование Fc-антител – потенциально все они заслуживают будущих исследований, пишут исследователи. Это исследование требует дальнейших исследований, чтобы понять, как фракции IgG, ассоциированные с aPL Ab, активируют эндотелиальные клетки.
* Важное примечание
medRxiv публикует предварительные научные отчеты, которые не рецензируются и, следовательно, не должны рассматриваться как окончательные, руководящие клинической практикой / поведением, связанным со здоровьем, или рассматриваться как установленная информация.
Ссылка в журнале:
- Антитела, активирующие эндотелиальные клетки, при COVID-19 Хуэй Ши, Ю Цзо, Алекс А. Ганди, Гаутам Суле, Шрилакшми Ялаварти, Келси Гокман, Жаклин А. Мэдисон, Цзиньтао Ван, Мелани Цзо, Юэ Ши, Джейсон С. Найт , Йогендра Канти, medRxiv, 2021.01.18.21250041; doi: https://doi.org/10.1101/2021.01.18.21250041, https://www.medrxiv.org/content/10.1101/2021.01.18.21250041v1
 Диэнай
Диэнай