Используя способность интерферона 1 типа стимулировать антагонистическую клеточную среду для репликации вируса, исследовательская группа из Франции определила DEAD-бокс-РНК-геликазу DDX42 как внутренний ингибитор ВИЧ, а также другие патогенные вирусы, такие как коронавирус тяжелого острого респираторного синдрома. 2 (SARS-CoV-2) и вирус Чикунгунья. Это убедительное исследование в настоящее время доступно на сервере препринтов bioRxiv *.
За последние 20 лет было выявлено множество клеточных белков с различными функциями, способных препятствовать различным этапам жизненного цикла ВИЧ. Этот эффект особенно силен, когда клетки человека предрасположены к интерферону.
Как и ожидалось, поиски ускорились с введением геномных нокаут-генетических скринингов CRISPR / Cas9, которые рекламируются как чрезвычайно устойчивые подходы к раскрытию новых регуляторов вирусных инфекций.
Многие РНК-геликазы из семейства DEAD-боксов (обнаруженные почти во всех организмах, где они играют ключевую роль в метаболизме РНК), как известно, контролируют жизненный цикл ВИЧ. Некоторые известные примеры – DDX3, DDX6 и DDX17; однако влияние DDX42 на репликацию ВИЧ никогда не изучалось.
Эта специфическая геликаза привлекла внимание группы ученых из Университета Монпелье и Монпелье GenomiX во Франции. Они стремились оценить влияние эндогенного DDX42 на инфекцию ВИЧ-1, а также последствия сверхэкспрессии фермента.
<img alt=" Стратегия экрана "height =" 243 "src =" http://www.news-medical.net/image.axd?picture=2020%2f10%2fSure.jpg "title =" Стратегия экрана "ширина = "995" />
Методы и обоснование
Исследователи использовали библиотеку единственной направляющей РНК CRISPR Knock-Out (GeCKO) Genome-Scale, чтобы сгенерировать популяции клеток, отключенные почти для каждого человеческого гена. Кроме того, использовали модельную клеточную линию глиобластомы T98G, поскольку она очень восприимчива к лентивирусной инфекции, а также способна подавлять ВИЧ-инфекцию после лечения интерфероном.
DDX42 – это известная непроцессивная геликаза, которая также обладает активностью отжига РНК и склонностью вытеснять РНК-связывающие белки из одноцепочечных РНК. Чтобы подтвердить специфический эффект DDX42 на инфекцию ВИЧ-1, исследователи использовали три различных малых интерферирующих РНК для подавления экспрессии DDX42.
Влияние истощения DDX42 тестировалось не только для ретровирусов и ретроэлементов, но и для пяти других вирусных семейств: вируса ортомиксовируса гриппа A, вируса альфавируса чикунгунья, вируса флавивируса Зика, вируса везикулярного стоматита рабдовируса, а также SARS-CoV-2, ответственный за продолжающуюся пандемию коронавирусного заболевания (COVID-19).
Широкая противовирусная активность эндогенного DDX42
«Здесь мы впервые идентифицировали РНК-геликазу DDX42 в качестве внутреннего ингибитора ВИЧ-1, способного ограничивать эффективность накопления вирусной ДНК», – говорят авторы исследования в этой захватывающей статье bioRxiv.
«Более конкретно, наше исследование выявило широкую активность эндогенного DDX42 среди ретровирусов и ретроэлементов, которая наблюдалась в различных типах клеток, включая первичные CD4 + Т-клетки», – добавляют они.
Истощение эндогенного DDX42 увеличивало инфицирование ВИЧ – как в модельных клеточных линиях, так и в Т-клетках или макрофагах, происходящих из моноцитов (которые являются физиологическими мишенями ВИЧ). Это наблюдалось независимо от лечения интерфероном.
Подобным образом сверхэкспрессия доминантно-отрицательного мутанта DDX42 оказала положительное влияние на ВИЧ-инфекцию, тогда как сверхэкспрессия DDX42 дикого типа оказала сильное ингибирующее действие. Более того, эндогенное истощение DDX42 было напрямую связано с увеличением накопления вирусной ДНК.
Интересным открытием было то, что DDX42 был способен ингибировать вирусы, принадлежащие к другим семействам, с совершенно другими стратегиями репликации, включая SARS-CoV-2 и чикунгунью. Тем не менее, DDX42 не оказал воздействия на все протестированные вирусы, в отличие от некоторых других противовирусных ингибиторов широкого спектра действия, таких как белки MxA.
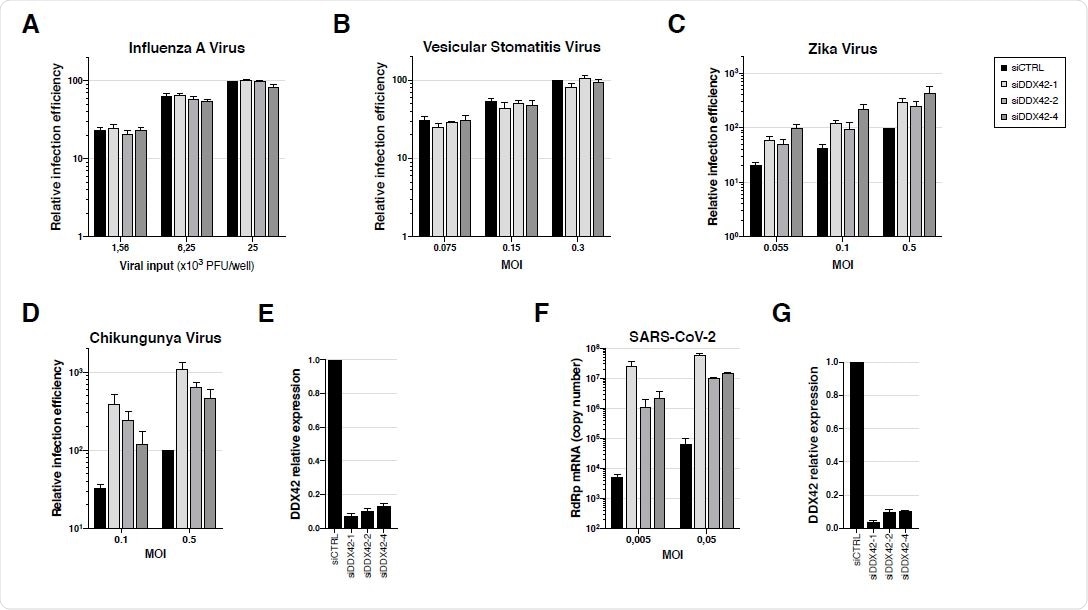
Эндогенный DDX42 не влияет на инфекцию VSV или IAV, является мягким ингибитором инфекции ZIKV и сильно подавляет репликацию как CHIKV, так и SARS-CoV-2. A. Клетки U87-MG трансфицировали siRNA или siRNA, не нацеленные на DDX42 (siDDX42-1, -2 и -4), и через 72 часа после трансфекции клетки инфицировали репортерным вирусом гриппа A, экспрессирующим нанолуциферазу. Сигналы нанолюциферазы измеряли через 16 часов. B. Клетки U87-MG, истощенные по контролю и DDX42, инфицировали репортером VSV, экспрессирующим Firefly, с указанными MOI. Сигналы Firefly были измерены через 24 часа. C. Клетки U87-MG, истощенные по контролю и DDX42, инфицировали ZIKV, экспрессирующим нанолуциферазу, с указанными MOI. Сигналы нанолюциферазы измеряли через 24 часа. D. Контрольные и обедненные DDX42 клетки U87-MG инфицировали Gaussia-экспрессирующим CHIKV при указанных MOI. Сигналы Gaussia были измерены через 24 часа. E. Количественная оценка эффективности подавления DDX42 в клетках U87-MG с помощью RT-qPCR. F. Клетки A549-ACE2 трансфицировали ненаправленной миРНК или миРНК, нацеленными на DDX42 (siDDX42-1, -2 и -4). Через 72 часа после трансфекции клетки инфицировали вирусом SARS-CoV-2 с указанными MOI и лизировали через 2 дня, их РНК извлекали и измеряли эффективность репликации SARSCoV-2 с помощью RT-qPCR с использованием праймеров и зонда RdRp. G. Количественная оценка эффективности подавления DDX42 в клетках A549-ACE2 с помощью RT-qPCR. Данные A-G представляют собой среднее значение ± S.E.M. трех независимых экспериментов.
Прямое изменение вирусных рибонуклеопротеидов
Наблюдая тесную близость между DDX42 и капсидом ВИЧ, можно выдвинуть гипотезу о прямом действии на комплексы вирусных рибонуклеопротеидов (RNP), что также подтверждается доступной научной литературой.
«Тем не менее, необходимы дальнейшие исследования, чтобы определить, действует ли DDX42 напрямую, изменяя вирусные рибонуклеопротеины, и, если это так, каковы детерминанты распознавания вирусных RNP», – предупреждают авторы исследования.
В заключение, это исследование подчеркивает важность понимания точных механизмов действия РНК-геликазы DDX42, а также ее вклада в контроль репликации РНК-вирусов. Это, в свою очередь, может дать информацию о будущих стратегиях противовирусного вмешательства.
* Важное примечание
bioRxiv публикует предварительные научные отчеты, которые не рецензируются и, следовательно, не должны рассматриваться как окончательные, руководящие клинической практикой / поведением, связанным со здоровьем, или рассматриваться как установленная информация.
 Диэнай
Диэнай