На первый взгляд, боковой амиотрофический склероз (БАС) и болезнь Альцгеймера имеют две общие черты: оба являются прогрессирующими изнуряющими нейродегенеративными состояниями, то есть симптомы ухудшаются, и, по крайней мере, на данный момент, ни одно из них не имеет эффективного лечения, не говоря уже о излечение.
На молекулярном уровне недавно выявленная связь между этими разрушительными болезнями могла бы помочь в поиске новых методов лечения, считает Джитан Миттал, заведующий кафедрой химической и биомолекулярной инженерии Сэма и Рут Мадрид в Университете Лихай. Россинский инженерный колледж.
Миттал и сотрудник Университета Брауна Николас Фаузи сосредоточены на TAR-ДНК-связывающем белке 43 или TDP-43. Нейронные отложения этого необходимого человеческого белка обнаруживаются у людей, живущих с болезнью Альцгеймера и связанными с ней типами деменции, а также с диагнозом БАС (также известным как болезнь Лу Герига).
Исследовательская группа получила грант в размере 3,3 миллиона долларов от Национального института здравоохранения на использование их совокупного опыта в методах структурной биологии – эксперимент Фаузи; Миттал, вычислительный – чтобы визуализировать атомистические детали сборки TDP-43, исследовать роль посттрансляционных модификаций и связанных с болезнью мутаций в процессах сборки и исследовать взаимодействия с несколькими многообещающими терапевтическими мишенями для предотвращения агрегации.
Результаты более ранних работ Миттала и Фаузи о TDP-43 были опубликованы в Трудах Национальной академии наук и Структура .
Наше предыдущее исследование – только вершина айсберга. Следующий шаг – взглянуть на действительные мутации, связанные с БАС и болезнью Альцгеймера, и понять, как они влияют на сборку TDP-43, чтобы лучше понять причины их неисправности. Затем мы можем поддержать исследователей, разрабатывающих новые терапевтические стратегии ».
Джитан Миттал, биофизик, Университет Лихай
Поиск ясности на фоне беспорядка
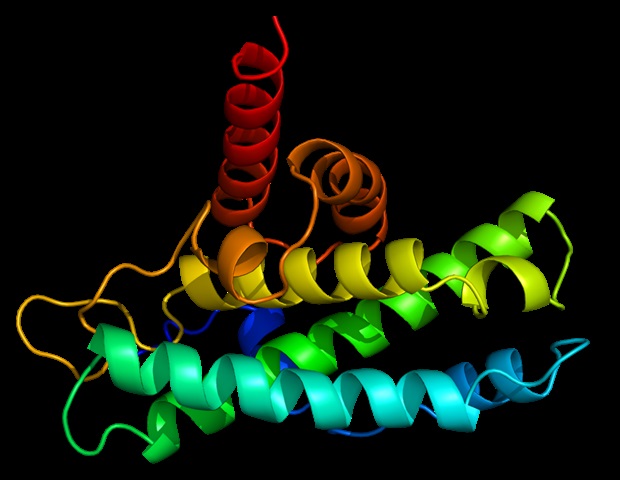
TDP-43 имеет две стороны – один конец молекулы состоит из плотно упакованных согнутых областей, в то время как другая сторона классифицируется как внутренне разупорядоченная область (IDR), поскольку ее части не имеют четко определенной структуры.
Миттал, биофизик, имеет давний интерес к IDR и разработал методы моделирования, чтобы помочь визуализировать, как эти белки складываются – или неправильно складываются, потенциально приводя к связанной с болезнью агрегации в организме.
Неорганизованная природа IDR, таких как TDP-43, облегчает образование безмембранных органелл в клетках посредством процесса, называемого разделением фаз жидкость-жидкость, феномен, который, по мнению Миттала, "покорил мир биологии. «
«Не так давно люди думали о формировании органелл или отделов внутри клеток, так же, как мы думали о здании, в котором комнаты разделены стенами, и в разных комнатах выполнялись разные функции», – объясняет он.
«Ожидалось, что информация внутри клеток и функции, которые выполняются внутри них, были сильно разделены на части. Но за последние 10 или 12 лет исследователи показали, что клетки не требуют стенок или мембран для создания отсеков».
«При разделении фаз жидкость-жидкость у вас есть хорошо смешанный раствор биомолекул, белков, РНК и т. Д., Которые внезапно сливаются в эти очень плотные жидкие капли. Но если что-то пойдет не так, и они Неправильно сформированные, эти гранулы становятся более твердыми и склонными к агрегации. "
TDP-43 является хорошо известным компонентом этих гранул, говорит он, и из-за известных генетических и других связей с БАС, лобно-височной деменцией и болезнью Альцгеймера дальнейшие исследования представляют интерес для НИЗ.
Команда изучает фундаментальные вопросы о структуре белка с помощью двух разных, но взаимодополняющих подходов: лаборатория Фаузи проводит очень сложные эксперименты по ядерному магнитному резонансу (ЯМР), подтверждая рыхлую, подобную лапше структуру белка посредством многочисленных усредненных значений вместе
. ]
Лаборатория Миттала проводит компьютерное моделирование на основе физики, которое предоставляет подробную пространственную и временную информацию и может предсказать, как мутации в TDP-43 могут влиять на фазовое поведение при образовании безмембранных органелл.
Объединение этих методов позволяет исследователям «по-настоящему получить механистическое представление о том, как каждый шаг, от атомов до молекул до уровня одного белка, соединяется», говорит Миттал.
«Изменение только нескольких атомов из сотен или тысяч внутри белка может повлиять на его функцию, сборку и взаимодействие, поэтому важно иметь полную картину».
«В противном случае вы работаете в темноте, просто бросаете все на это и смотрите, что работает. Мы пытаемся получить лучшее понимание, чтобы мы могли ориентироваться в нашем подходе и направлять эксперименты прогнозным способом».
Источник:
Ссылка на журнал:
Conicella, A.E., и др. . (2020) α-спиральная структура TDP-43 регулирует разделение и функцию фазы жидкость-жидкость . Труды Национальной академии наук. doi.org/10.1073/pnas.1912055117.
 Диэнай
Диэнай