Почему вы решили исследовать сперматозоиды и ЭКО?
Моя академическая карьера была в значительной степени направлена на исследование новых, но в то же время высокопрагматичных методов оптической микроскопии 3D-изображений для биомедицинских применений с акцентом на 3D-визуализацию биологических клеток без пятен in vitro.
Из различных областей применения этих технологий ЭКО является очень заметной областью, где хотелось бы получить «гораздо больше» информации о наблюдаемых клетках, одновременно сводя к минимуму повреждение этих клеток.
Для сравнения, при типичной патологии вы можете использовать окрашивающие химические вещества на биологическом образце, так как после анализа образец либо выбрасывается, либо архивируется, но никогда не возвращается обратно в организм человека.
<img alt=" ЭКО "высота =" 667 "src =" http://www.news-medical.net/image.axd?picture=2020%2f5%2fshutterstock_1452576479.jpg "title =" ЭКО "width =" 1000" />
Изображение предоставлено: Maxx-Studio / Shutterstock.com
Что такое ЭКО?
В своем более узком (и более точном) определении, обычное ЭКО (экстракорпоральное оплодотворение) представляет собой процедуру, при которой яйцеклетку помещают в чашку Петри вместе с большой популяцией сперматозоидов и некоторой поддерживающей средой, а также оплодотворяют яйцеклетка одной из сперматозоидов, как ожидается, состоится.
Более продвинутый и распространенный тип ЭКО известен как ИКСИ (интрацитоплазматическая инъекция сперматозоидов), так как некоторые исследования показали большую вероятность оплодотворения при непосредственном отборе и введении одной яйцеклетки в яйцеклетку. Эти процедуры относятся к общей области АРТ (технологии искусственного воспроизводства).
Как вы разработали безопасный и точный метод 3D-визуализации для мониторинга движения и качества сперматозоидов?
Мы разработали клинические голографические установки, которые могут визуализировать отдельные биологические клетки без значительного контрастирования и получать гораздо больше информации, чем это возможно при регулярном окрашивании (что недопустимо в ЭКО или ИКСИ).
Голография использует оптическую интерференцию луча образца с опорным лучом для регистрации задержки света, проходящего через образец, и, таким образом, дает количественный контраст изображения без меток.
Таким образом, мы записываем полный волновой фронт выборки, содержащий карту оптической толщины или карту OPD (задержка оптического пути) ячейки, так что в каждой точке на этой карте OPD равен интегралу от показателя преломления значения по толщине ячейки.
Мы использовали очень слабый луч света, чтобы избежать повреждения генетического материала.
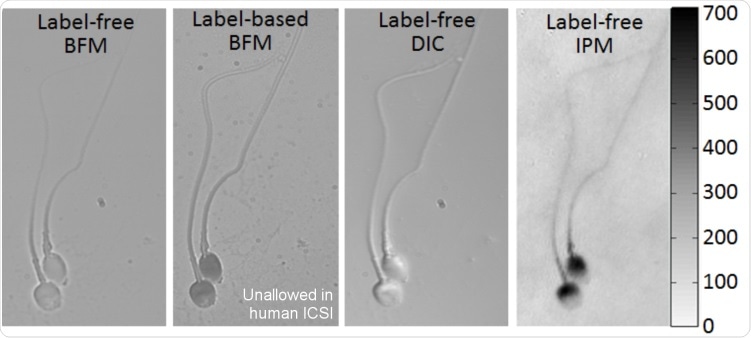
На рисунке ниже представлены изображения сперматозоидов, полученные в моей лаборатории, которые демонстрируют различия между качественной информацией, получаемой с помощью светлопольной микроскопии (BFM), даже при использовании маркировки или окрашивания для усиления контраста, дифференциальной интерференционной контрастной (DIC) микроскопии , который является одним из обычно используемых методов качественной фазовой визуализации и голографии, или интерферометрической фазовой микроскопии (IPM), которая позволяет количественно измерять оптическую толщину клетки во всех ее точках.
Значения на топографической карте OPD пропорциональны поверхностной плотности сухой массы изображаемой клетки, которая является примером клеточного параметра, который до сих пор не был доступен для клиницистов.
Получение изображений тех же сперматозоидов с помощью типичных качественных методов микроскопии и количественной IPM (голографии), обеспечивающих топографическую карту OPD, полученную в моей группе. Цветная полоса справа представляет значения OPD в нм для голографического изображения. BFM = светлопольная микроскопия. DIC = дифференциальный интерференционный контраст, IPM = интерферометрическая фазовая микроскопия (голография).
Голография, как правило, основана на зрелой технологии измерения волнового фронта. Тем не менее, до недавнего времени он не мог быть реализован в клиниках из-за его громоздкости, непереносимости и требований к определенным оптическим навыкам для его настройки и использования.
За последние несколько лет мы приложили значительные усилия и смогли сделать эти датчики волнового фронта доступными для непосредственного клинического использования.
Мы используем компактные и портативные модули, которые можно подключать к существующим лабораторным микроскопам и предоставлять голографические данные с таким же или даже лучшим качеством по сравнению с данными, предоставляемыми гораздо более громоздкими и дорогими установками.
Действительно, используя эти установки, мы показали, что готовые к клиническим испытаниям голографические установки могут отображать сперматозоиды с превосходным контрастом без окрашивания, обладая потенциалом для обнаружения фрагментации ДНК в сперматозоидах без окрашивания, а также фактически окрашивая их, что означает демонстрацию клетки, как они были химически окрашены (недавняя статья PNAS).
Голография предоставляет только топографическую карту OPD. Он не имеет возможности внутриклеточного среза и не может обеспечить трехмерное изображение x – y – z.
Для обеспечения возможности визуализации всего трехмерного изображения используется интерферометрическая томография, где многие голографические проекции с разных углов собираются и обрабатываются для создания трехмерной карты показателя преломления.
Чтобы обеспечить сбор голографических проекций для нескольких углов обзора, существует два подхода: вращение всего образца или сканирование освещения.
Однако ни один из этих методов не может справиться с проблемой получения трехмерного изображения без меток высокого разрешения сверхбыстрых динамических клеток, таких как сперматозоиды, свободно плавающие, поскольку вращение образца или освещение требуют времени.
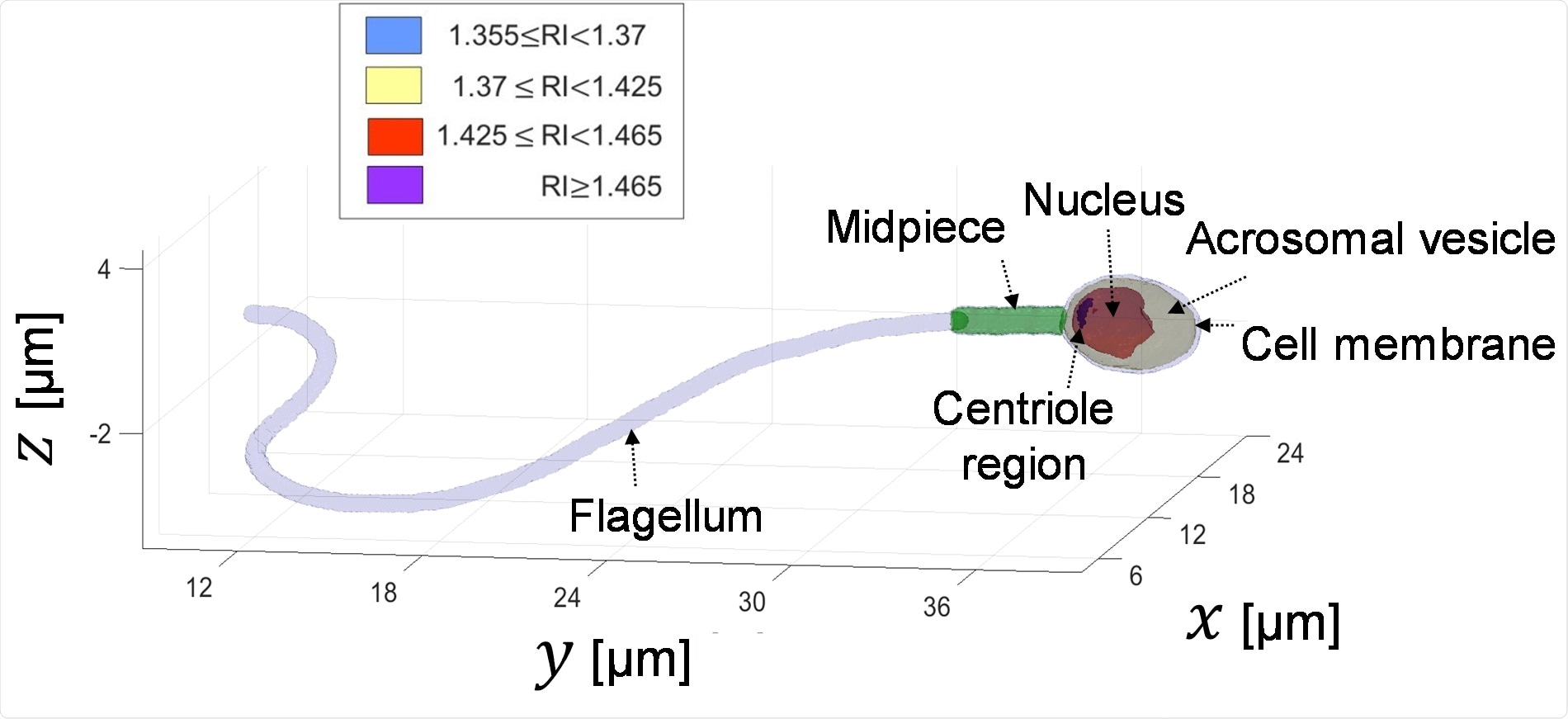
В нашей недавней статье Science Advances мы представили первую интерферометрическую томографию с высоким разрешением для трехмерного получения всей сперматозоида (голова с органеллами и хвостом) во время свободного плавания и без окрашивания клеток.
Мы достигли как трехмерного профиля показателя преломления сперматозоида, выявив его тонкие внутренние органеллы и изменяющуюся во времени ориентацию, так и детальной 4D (в пространстве и времени) локализации тонкого, высоко динамичного хвоста сперматозоида.
Томография головки сперматозоида основана на том факте, что сперма вращает свою голову естественным образом во время свободного плавания, поэтому она дает нам «свободную» возможность записывать свои голографические проекции. Этот метод имеет большой потенциал как для биологических анализов, так и для клинического использования интактных сперматозоидов, поскольку он обеспечивает динамическую 3D (или 4D) визуализацию.
См. Рисунки ниже.
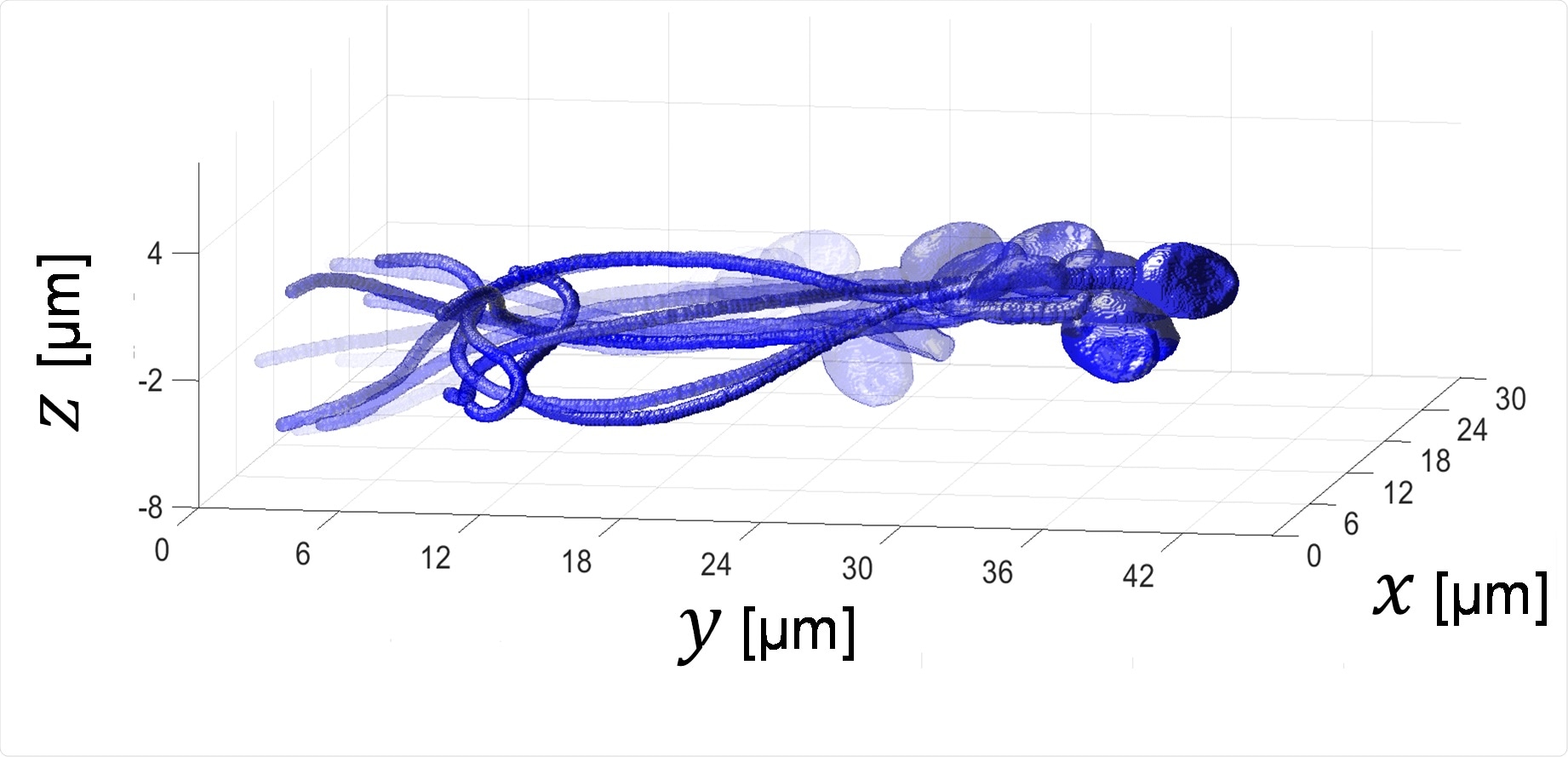
4-мерное изображение спермы: трехмерное получение сперматозоида во время свободного плавания без окрашивания.
Скорость съемки: 2000 кадров в секунду, продолжительность: полсекунды.
Визуализация внутренних органелл сперматозоида, которые можно различить по значениям их показателя преломления (RI). Это делается во время плавания спермы и без окрашивания.
Какие преимущества имеет ваш новый метод визуализации по сравнению с другими методами визуализации, ранее использовавшимися в ЭКО?
Что касается наших обычных голографических методов, то ВОЗ (Всемирная организация здравоохранения) и клиническое и научное сообщество репродуктивной медицины довольно точно охарактеризовали внутреннюю структуру «хороших» сперматозоидов; Однако, чтобы оценить, соответствуют ли сперматозоиды этим критериям, необходимо химически окрасить клетки и тем самым сделать их непригодными для использования при ЭКО.
Наша голографическая методика позволяет эмбриологу иметь всю информацию, необходимую для применения критериев ВОЗ, а также гораздо более проницательную информацию об отдельных наблюдаемых сперматозоидах, например уровень фрагментации ДНК.
Теперь мы даже лучше, чем этот, поскольку наш томографический подход обеспечивает полное получение 3D-динамики спермы (а не только одну голографическую проекцию). Анализ может быть выполнен вручную эмбриологом или автоматически компьютером.
Поскольку 4D изображения сперматозоидов, выбранных для оплодотворения, теперь записываются (в отличие от обычной практики сегодня), и они содержат много новых параметров, таких как объем органелл спермы и ее полная трехмерная динамика, База данных сперматозоидов может быть построена, проанализирована путем глубокого изучения, а затем использована для расследования причин успеха / неудачи пары, которая устанавливает новый инструмент персонализированной медицины.
Почему важно, чтобы тест на изображение был безопасным для использования на сперматозоидах?
Существуют очень строгие нормативные указания по безопасности для гамет (например, яйцеклеток и сперматозоидов), которые предназначены для создания эмбрионов in vitro и, очевидно, они могут превратиться в детей.
Почему окрашивание сперматозоидов не разрешается при ЭКО?
Существуют различные типы пятен, однако при окрашивании может потребоваться «убить» сперматозоид, разрушив его наружную мембрану, чтобы проникнуть (т.е. проникнуть) в нее с помощью конкретного маркирующего агента и внутренне связаться с молекулой-мишенью, которая может быть белком в ядре, акросоме, цитоплазме и т. д.
Кроме того, процедуры ЭКО человека обычно не позволяют использовать даже флуоресцентные красители для живых сперматозоидов из-за риска повреждения генетического материала сперматозоидов.
Почему качество спермы так важно при лечении ЭКО?
Лучший отбор спермы приведет к улучшению показателей и результатов беременности. Клинические результаты отмечаются при одном живорождении из приблизительно шести циклов ЭКО.
Как правило, все яйцеклетки оплодотворяются сперматозоидами при средней обработке ЭКО из-за их небольшого количества (около десяти яиц), но индивидуальный отбор сперматозоидов из миллионов находится в центре среднего лечения ЭКО и имеет медицинский, финансовый эмоциональное, социальное и профессиональное влияние на пары, пытающиеся стать родителями. Каждая сперматозоид приводит к тому, что в случае успешной беременности у каждого человека появляется другой человек.
Считается, что очень индивидуальная сперма, которая в конечном итоге оплодотворяет яйцеклетку, играет такую же важную роль в определении судьбы беременности, как и яйцеклетка. Типичная культура эмбрионов в течение 3 или 5 дней позволила бы лишь частично увидеть всестороннее «качество» эмбриона и его шансы родить живорожденных.
Действительно, существуют относительно новые методы, которые используются в качестве замены для амниоцентеза, который обычно называют ПГД или ПГС, но в основном они были бы адекватны, чтобы попытаться идентифицировать определенные генетические признаки, поэтому эти разработки не конкурируют, но скорее дополняем друг друга.
Кроме того, мы не хотим сталкиваться с ситуацией, в которой все яйца в цикле ЭКО оплодотворяются дефектными сперматозоидами.
<img alt=" ICSI "height =" 750 "src =" http://www.news-medical.net/image.axd?picture=2020%2f5%2fshutterstock_137815964.jpg "title =" ICSI "width =" 1000" />
Изображение предоставлено: nobeastsofierce / Shutterstock.com
Как этот метод поможет улучшить будущие методы лечения ЭКО?
Мы полагаем, что точно так же, как любой современный эмбриолог использовал бы свой стандартный микроскоп, чтобы посмотреть, как сперматозоид-клетка-кандидат плавает или вообще имеет форму, в недалеком будущем мы увидим, как многие эмбриологи применяют всесторонний скрининг спермы-кандидата. клетки, прежде чем индивидуально вводить их в извлеченные яйца.
В дальнейшем мы намерены создать всеобъемлющую базу данных трехмерных изображений, не содержащих пятен сперматозоидов, и вместе с изображениями эмбрионов и информацией о клинических результатах, а также с использованием методологий глубокого изучения проложить дорогу для следующего поколения больших данные выбора спермы на основе AI.
Считаете ли вы, что ваша техника визуализации может помочь в диагностике мужских проблем с фертильностью?
Одна из шести пар страдает проблемами с фертильностью. Считается, что 1/3 всех случаев бесплодия обусловлены исключительно мужским фактором, 1/3 исключительно женскими факторами, а остальные 1/3 объединены.
Клиническая оценка того, относится ли случай к одной из этих групп, обычно проводится после нескольких рутинных клинических и лабораторных исследований, проведенных с парой, включая анализ спермы.
Наша методика основана на уникальной прямой визуализации сперматозоидов без пятен на рабочей станции клинического уровня.
В нашем исследовании мы стремились разработать совершенно новый тип технологии визуализации, которая обеспечила бы как можно больше информации о сперматозоидах и позволила бы выбрать оптимальный сперматозоид при оплодотворении. Как объяснялось выше, мы выбрали голографическую томографию.
Используя нашу методику, мы считаем, что быстрый, дешевый и простой тест может подтвердить или опровергнуть эти потенциальные объяснения бесплодия.
В нашей статье «Фертильность и стерильность» мы показали, что мы можем добиться того же результата, что и протокол Всемирной организации здравоохранения (ВОЗ), для окрашивания клеток, но без окрашивания. И это было только с помощью одной голографической проекции.
Вместе с генеральным директором Алоном Шалевым я основал компанию QART Medical, которая должна внедрить эту технологию в клиниках в течение ближайших 2 лет. В компании мы создали несколько клинических аппаратов для визуализации спермы и, как ожидается, скоро начнут клинические испытания.
Теперь мы стали еще лучше, поскольку у нас очень быстрый метод 3D-визуализации для всей спермы (головы и хвоста) без окрашивания. Таким образом, мы можем соотнести трехмерную динамику сперматозоидов с ее морфологией и понять механизмы отбора сперматозоидов в организме женщины.
Каковы следующие шаги в вашем исследовании?
Мы создали несколько рабочих прототипов в моей лаборатории для голографической визуализации в клинических условиях, изобразили тысячи сперматозоидов, проанализировали их и провели различные анализы опытных клинических эмбриологов для проверки нашей методики (см. Публикации ниже).
Мы хотим как можно быстрее внедрить эту технологию в клинику, что позволит использовать ее для ЭКО и ИКСИ человека.
Используя нашу новейшую технику 4D-визуализации, я планирую изучить динамическое поведение сперматозоидов в различных сценариях, чтобы построить единую биофизическую и биомеханическую модель, которая соединяет морфологию, движение и содержимое спермы 3D.
Я также планирую проверить все возможности нашей новой техники 4D визуализации без пятен при обнаружении различных морфологических деталей, которые не могли быть обнаружены до сих пор во время ЭКО и ИКСИ, и количественно оценить их клиническую значимость, а также проверить наши технические возможности в измерение уровня фрагментации ДНК в сперматозоидах.
Где читатели могут найти дополнительную информацию?
Исследовательская группа: www.eng.tau.ac.il/~omni
Компания: www.qart-medical.com
Конкретные соответствующие научные труды:
- G. Дардикман-Йоффе, С. К. Мирский, И. Барнеа и Н. Т. Шакед, «Получение в 4-D высокого разрешения свободно плавающих сперматозоидов человека без окрашивания», Science Advances, Vol. 6, No. 15, eaay7619, 2020 [PDF, Supp Mat, Video 1, Video 2, Video 3, Video 4, Video 5] [Link].
- У. Н. Найгейт, М. Леви, С. К. Мирский, Н. А. Турко, М. Рубин, И. Барнеа, Г. Дардикман-Йоффе, М. Хайфлер, А. Шалев, Н. Т. Шакед, «Голографическое виртуальное окрашивание отдельных биологических клеток» Труды Национальной академии наук США (PNAS), 2020 [PDF] [Link].
- М. Хайфлер, П. Гиршовиц, Г. Бэнд, Г. Дардикман, И. Маджар и Н. Т. Шакед. Интерферометрическая фазовая микроскопия для безметочной морфологической оценки сперматозоидов. Плодородие и стерильность. 104, Issue 1, pp. 43-47, 2015 [View].
- я. Барнеа, Л. Карако, С. К. Мирский, М. Леви, М. Бальберг и Н. Т. Шакед. Корреляционная микроскопия интерферометрической фазы без пятен с окрашиванием фрагментацией ДНК в сперматозоидах человека, Journal of Biophotonics, Vol. 11, e201800137, стр. 1-10, 2018 [Link].
- Р. Якоб Эравучира, С. К. Мирский, И. Барнеа, М. Леви, М. Бальберг и Н. Т. Шакед, «Индивидуальный отбор сперматозоидов с помощью микрофлюидики, интегрированной с интерферометрической фазовой микроскопией», Methods, Vol. 136, стр. 152-159, 2018 [Link].
- S. К. Мирский, И. Барнеа, М. Леви, Х. Гринспен и Н. Т. Шакед, «Автоматический анализ отдельных сперматозоидов с использованием интерферометрической фазовой микроскопии без окрашивания и машинного обучения», Цитометрия, часть A, Vol. 91, Issue 9, pp. 893-900, 2017 [Link].
- М. Бальберг, М. Леви, К. Калиновский, И. Барнеа, С. Мирский, Н. Т. Шакед, «Локализованные измерения физических параметров в сперматозоидах человека, полученные с помощью широкопольной интерферометрии», Journal of Biophotonics, Vol. 10, Issue 10, 1305-1314, 2017 [Link].
О профессоре Натане Шакеде
проф. Натан Т. Шакед является штатным доцентом и директором исследовательской группы по биомедицинской оптической микроскопии, наноскопии и интерферометрии (OMNI) (www.eng.ac.il/~omni), большой исследовательской группы, входящей в состав Департамента. биомедицинской инженерии и нано-центра Тель-Авивского университета, Тель-Авив, Израиль.
Расположенная в трех лабораторных помещениях, группа проводит междисциплинарные исследования, включающие оптическую визуализацию и зондирование в биологических системах. До апреля 2011 года профессор Шакед был доцентом кафедры биомедицинской инженерии в Университете Дьюка, Дарем, Северная Каролина, США. <img alt=" Профессор Натан Шакед "height =" 270 "src =" http: // www. news-medical.net/image.axd?picture=2020%2f5%2fNatanShaked_Bio2.jpg "style =" float: right; "title =" Профессор Натан Шакед "width =" 180 "/>
Шакед имеет степень бакалавра, магистра и доктора философии. степени в области электротехники и вычислительной техники. Профессор Шакед является соавтором более 80 рецензируемых журнальных статей и 150 конференционных докладов, нескольких глав книг, патентов и отредактированной книги.
Он председательствует на ежегодной конференции SPIE по визуализации и зондированию без меток (LBIS) в SPIE Photonics West, Сан-Франциско, США, и является соучредителем QART Medical Ltd (www.qart-medical.com). Профессор Шакед выиграл много престижных исследовательских грантов, включая личный грант HORIZON2020 ERC, который финансировал это исследование.
 Диэнай
Диэнай