Интервью доктора Эми Джонсон и доктора Льюиса Фрэнсиса
Пожалуйста, сделайте обзор эпигенетики и важности изучения факторов, влияющих на человеческую эпигенетику.
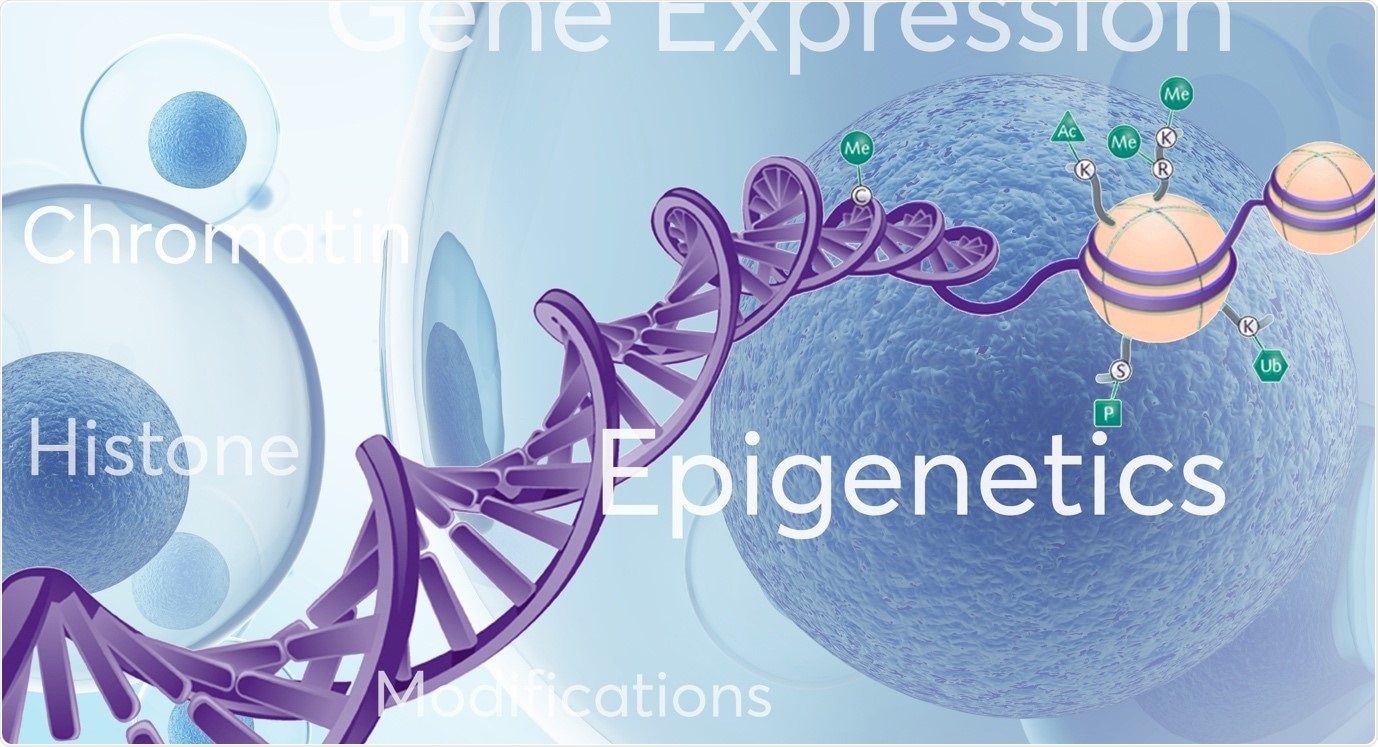
Эпигенетика относится к изменениям или модификациям генетической последовательности, которые происходят «вокруг», «сверху» или «в дополнение» к традиционной генетике. Возможны несколько типов эпигенетических модификаций, включая метилирование ДНК, модификации гистонов (ацетилирование, метилирование), позиционирование нуклеосом и РНК-ассоциированное молчание. Эти хорошо изученные эпигенетические механизмы влияют на доступность генов для активации (включения или выключения), что, в свою очередь, влияет на паттерны экспрессии генов и важные клеточные процессы.
Изображение предоставлено: Porvair Sciences
Эпигеномные регуляторные паттерны управляют механизмами роста и дифференцировки клеток, участвующими в развитии и патологии. Примечательно, что технологические достижения теперь позволяют расшифровывать общегеномные паттерны на основе многомерных измерений, открывая сложные карты молекулярной связи между геномом и его функциональным результатом.
Картирование динамики доступности хроматина и структуры хроматина более высокого порядка позволило на новом уровне понять решения, идентичность и функции клеток при нормальном развитии, физиологии и болезнях.
Как вирус может использовать эпигенетические кофакторы, чтобы нарушить регуляцию клеточных путей и помочь контролировать его жизненный цикл?
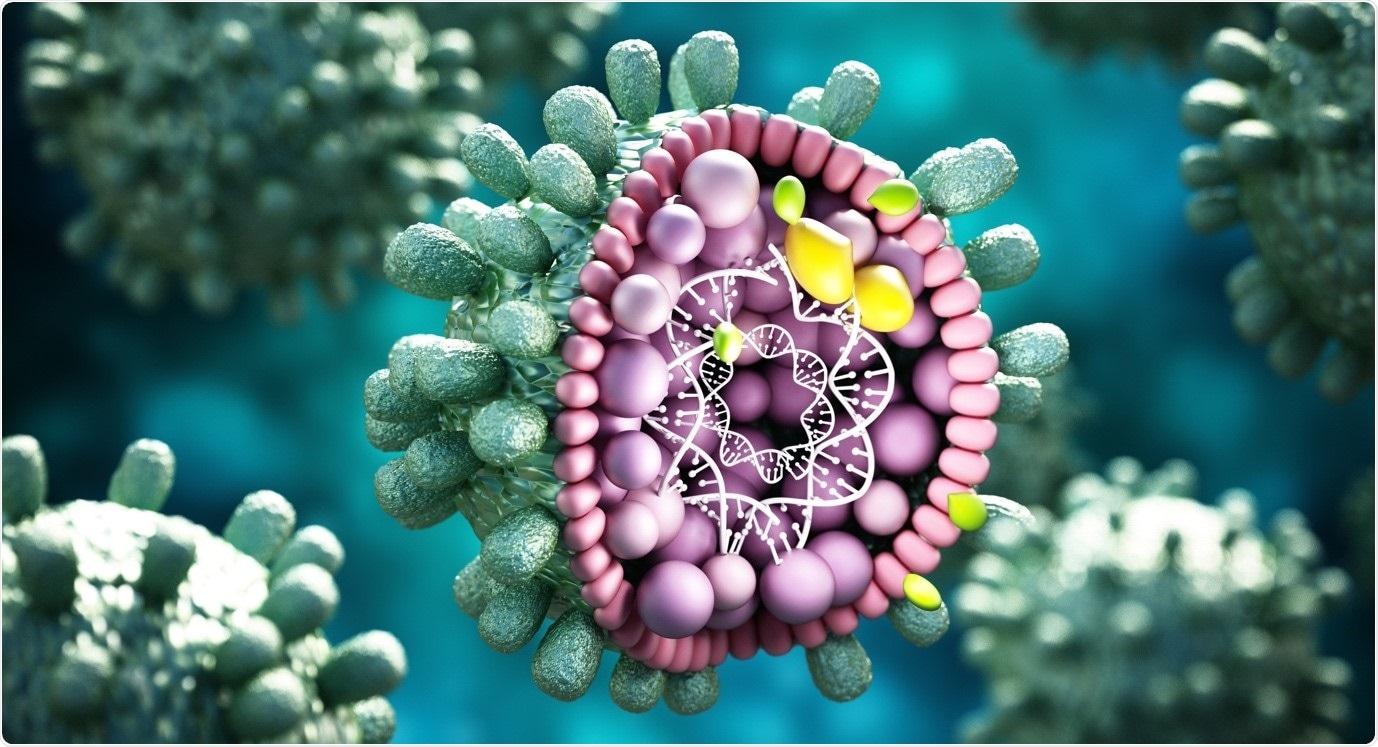
Появляется все больше свидетельств того, что вирусы используют эпигенетические процессы для управления своими жизненными циклами. Роль, которую эпигенетика играет в регуляции вирусных инфекций, еще полностью не выяснена, а эпигенетическая регуляция экспрессии вирусных генов только недавно начала появляться. Эпигенетическая регуляция при вирусных инфекциях обычно двунаправленная.
Вирус будет использовать клеточные факторы хозяина для транскрипции или репликации и эпигенетические кофакторы, такие как гистонацетилазы, деацетилазы, метилазы и деметилазы, для контроля своего жизненного цикла. Было показано, что вирусные патогены эпигенетически нарушают регуляцию клеточных путей для оптимизации собственной транскрипции или репликации или уклонения от врожденного иммунного ответа клеток.
Для многих типов вирусов персистентность ядер зависит от хроматизации генома, когда ДНК вируса связывается с белками ядра гистонов, образуя эписомы во время скрытой инфекции. Интегрирующие вирусы, такие как ретровирусы и лентивирусы, вставляют свою ДНК в геномы хозяина, облегчая ассоциации гистонов, так что вирусный хроматин затем подвергается модификациям гистонов. Этот вирусный эпигеном, как и аппарат клетки-хозяина, оказывает значительное влияние на экспрессию и репликацию вирусных генов.
Изображение предоставлено: Porvair Sciences
Большое семейство вирусов, вирусы папилломы человека, содержат кольцевой, двухцепочечный ДНК-геном, и его жизненный цикл зависит от конечной дифференцировки клетки-мишени в эпителии – кератиноцита.
Жизненный цикл вируса начинается в базальном эпителии, при этом вирусный хроматин поддерживается в эпигенетически репрессированном состоянии, стабилизированном взаимодействием дистального хроматина между вирусным энхансером и областью раннего гена.
Миграция инфицированного кератиноцита к поверхности эпителия вызывает клеточную дифференцировку, которая нарушает образование петель хроматина и стимулирует эпигенетическое ремоделирование вирусного хроматина. Эти эпигенетические изменения приводят к усилению транскрипции вируса и активации позднего промотора вируса, способствующего транскрипции белков вирусного капсида.
Какое влияние может оказать это нарушение регуляции на клетки и органы?
Вирусы нарушают биологию клетки-хозяина и эпигенетические процессы, чтобы способствовать собственной репликации. Это вызовет нестабильность биологических процессов в организме хозяина за счет нарушения таких факторов, как репликация и транскрипция ДНК, и может ингибировать пути иммунного ответа.
Важно отметить, что вирусная инфекция не является синонимом болезни, поскольку многие вирусные инфекции являются субклиническими (т. Е. Бессимптомными, неявными), тогда как другие приводят к заболеваниям различной степени тяжести, которые обычно сопровождаются характерными клиническими признаками у пораженных. хост. Вирус заражает своего хозяина, распространяется, а затем повреждает ткани-мишени.
При большом разнообразии стратегий, направленных на обеспечение собственного выживания, существует также широкий спектр сопутствующих заболеваний и патогенных механизмов. Несмотря на то, что вирусы сильно различаются по своей вирулентности, даже популяция, инфицированная одним вирусом, будет демонстрировать поразительную неоднородность результатов заражения отдельных животных, как было недавно показано. В некоторой степени это можно объяснить широким спектром молекулярных и клеточных воздействий.
Инфекция часто связана с изменениями в морфологии, физиологии клеток и последовательными биосинтетическими событиями – всеми изменениями, которые необходимы для эффективной репликации вируса. В результате округления клеток, слияния с окружающими клетками и образования цитоплазматических телец включения, которые представляют скопления вирусных компонентов, клеточные проявления часто приводят к гибели клетки-хозяина.
Было показано, что физиология клеточной мембраны значительно изменена с точки зрения ионных движений и / или каскадов активации, ведущих к измененной клеточной активности, сосредоточенной на воспалении и метаболизме. Как указано здесь, нацеливание на клетки и ядра, иногда посредством эпигеномных процессов, часто подавляет синтез макромолекул клетки-хозяина, включая ДНК, РНК и белки.
Сообщалось также о специфических генотоксических эффектах при инфекции, приводящей к хромосомному разрыву, фрагментации или анеуплоидии. Нарушение регуляции таких центральных клеточных и молекулярных процессов приводит к значительным функциональным модификациям, изменению формы клеток, характеристик роста, закрепления, а также антигенных или иммунных свойств. В некоторых случаях для опухолевых вирусов как ДНК, так и РНК они могут опосредовать множественные изменения, приводящие к злокачественной трансформации.
Пожалуйста, дайте обзор иммунопреципитации хроматина (ChIP).
ChIP – мощный инструмент в изучении эпигенетики, используемый для выявления ассоциаций определенных белков (модифицированных и немодифицированных) с определенными участками генома. В анализе ChIP комплексы ДНК-белок избирательно иммунопреципитируют с использованием совпадающих антител, и полученные фракции обрабатывают для разделения компонентов ДНК и белка. 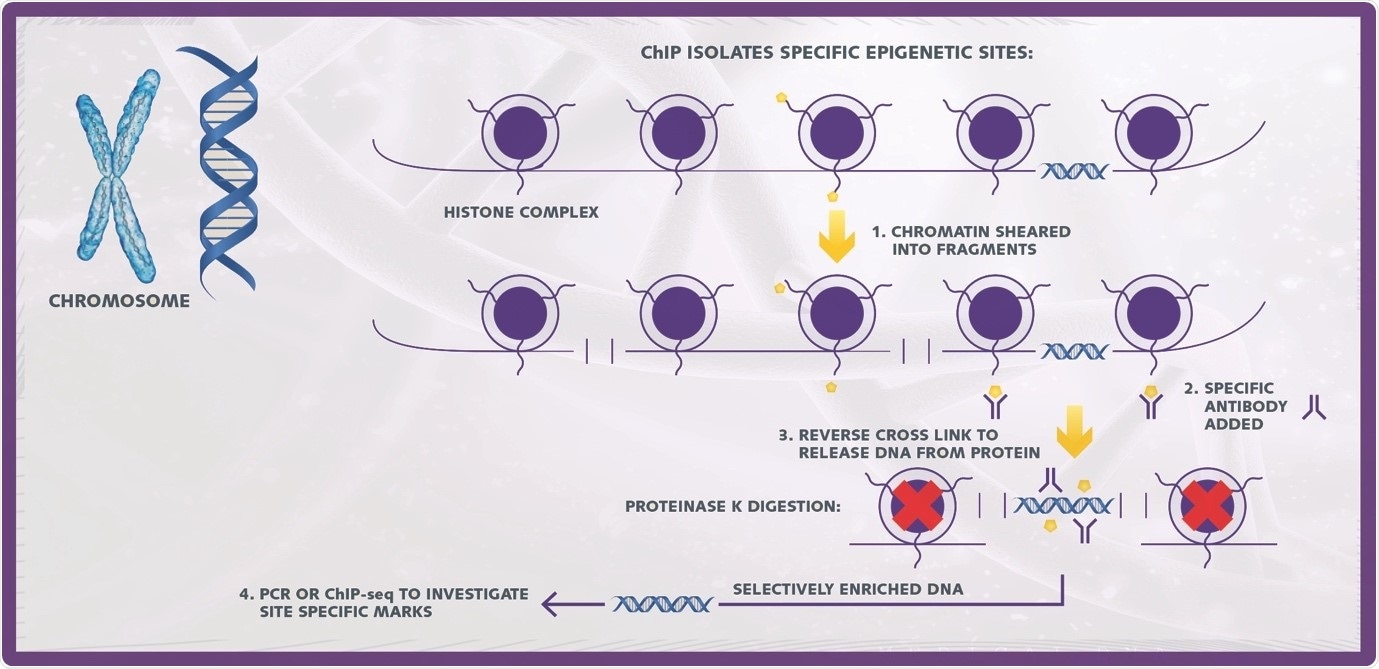
Изображение предоставлено: Porvair Sciences
Базовый анализ ChIP состоит из 5 основных этапов
- Выделение хроматина
- Сдвиг хроматина
- Иммунопреципитация
- Обратное сшивание и очистка ДНК
- Обнаружение нисходящего потока
Использование антитела, которое нацелено на специфическую эпигенетическую регуляцию на стадии иммунопреципитации, и количественная ПЦР или секвенирование следующего поколения позволяют исследователям анализировать эпигенетический ландшафт отдельного гена или всего генома.
Как можно использовать ChIP для понимания вируса и его влияния на наши эпигенетические системы?
Эпигеном может отличаться от типа клетки к типу клетки, и в каждой отдельной клетке он потенциально может модулировать экспрессию генов множеством способов; путем организации ядерной архитектуры хромосом, ингибирования или облегчения доступа факторов транскрипции к ДНК и опосредования экспрессии генов.
Расшифровка этих многогранных аспектов эпигенома имеет решающее значение для понимания как паттернов экспрессии генов, специфичных для конкретных типов клеток, так и того, как вирусная инфекция разрушает и использует эпигенетические паттерны клетки-хозяина.
ChIP и ChIP-seq позволяют определять местоположение гистонов и вариантов гистонов, связанных с вирусной функцией, наряду с локализацией представляющих интерес белков, таких как ДНК-связывающие факторы транскрипции и другие эпигенетические сложные белки, для расшифровки сложных регуляторных процессов, которые могут стать захвачен вирусом.
Как показано на примере SV40, лучшее понимание механизмов, ответственных за введение и чтение эпигенетической информации, приведет к новым методам лечения вирусных инфекций, многие из которых являются серьезными патогенами для человека.
Характеристика механизмов, лежащих в основе каждой формы эпигенетической регуляции, и анализ сложного взаимодействия между вирусными последовательностями ДНК может выявить вирусные белки и клеточные факторы, которые приведут к новым мишеням для терапевтического вмешательства.
Короче говоря, анализы ChIP могут определять местонахождение индуцированных вирусами эпигенетических манипуляций, связанных с важными клеточными функциями. Выявление функциональных эпигенетических комплексов, поддающихся терапевтическому нацеливанию, клеточные факторы, которые опосредуют модификацию хроматина, стали привлекательной мишенью для широкого спектра противовирусной терапии, сродни прогрессу, наблюдаемому в условиях ВИЧ.
Каковы преимущества и ограничения использования ChIP для исследования вирусов?
Преимущества заключаются в том, что эпигенетические метки хорошо охарактеризованы и широкий спектр отличных антител хорошо охарактеризован. ДНК-вирусы из-за их небольших размеров, простоты генетических манипуляций и относительно большого количества хроматина, которое может быть получено при инфекциях, являются эффективными мишенями для анализа типа ChIP-seq. С текущими подходами к NGS, хорошо развитыми в процессе разработки, может быть достигнуто высокое разрешение с одним основанием, позволяющее идентифицировать тонкие изменения в расположении нуклеосом.
Изображение предоставлено: Porvair Sciences
Поскольку ChIP будет предоставлять информацию только об эпигенетическом ландшафте в фиксированный момент времени, однако следует уделить важное внимание другим подходам, основанным на омиксах – как ДНК / РНК, так и белковые, чтобы контекстуализировать паттерны уровня хроматина, наблюдаемые при функциональной изменения в экспрессии генов.
Как ChIP использовался для понимания нового коронавируса?
Эпигенетическая регуляция была предметом пристального внимания из-за ее потенциальной способности поддерживать стабильную экспрессию генов, когда это необходимо, с гибкостью реагирования на изменения в окружающей среде.
Коронавирусная болезнь-2019 (COVID-19) респираторное заболевание, вызванное тяжелым острым респираторным синдромом, коронавирусом 2 (SARS-CoV-2), представляет собой новый одноцепочечный РНК-вирус семейства Coronaviridae . Заболевание может быть связано с тяжелыми респираторными проявлениями, цитокиновым штормом и смертью.
Возникновение Covid-19 и вариации в прогрессировании заболевания среди пожилых людей, людей с сопутствующими заболеваниями, а также кажущихся здоровыми людей, несомненно, представляют собой комбинацию нескольких факторов, в которых эпигенетика может играть важную роль.
В критических случаях Covid-19 иммунная система активируется и переходит в режим перегрузки, в результате чего иммунная система атакует здоровые клетки организма и в конечном итоге приводит к гибели клеток и отказу органа. Различная эпигенетическая регуляция иммунных факторов, таких как цитокины, может быть причиной некоторых пациентов, страдающих более серьезными симптомами Covid-19.
Недавнее исследование, опубликованное Sawalha et al., Показало, что избыточная экспрессия ACE2 e xacerbates дефект метилирования ДНК у пациентов, страдающих волчанкой, что делает их более восприимчивыми к тяжелым респираторным осложнениям и смерти. Они определили, что врожденная эпигенетическая дисрегуляция при волчанке может способствовать проникновению вируса, виремии и чрезмерному иммунному ответу на SARS-CoV-2.
Как результаты ChIP могут помочь исследователям в открытии и разработке терапевтических вирусных методов лечения?
Существует несколько предлагаемых стратегий клинического ведения. Однажды такая гипотеза основана на связи между лекарственными эпигенетическими модификациями и врожденным иммунным ответом, опосредованным INF. Пути IFN являются ключевыми путями противовирусного ответа, индуцируемого на ранних стадиях инфекций путем восприятия клеточной поверхности и транскрипционной активации генов, стимулированных INF, как противовирусных эффекторов.
У других вирусов, таких как грипп A, эти процессы инактивируются с использованием репрессивных комплексов хроматина, таких как polycomb, который опосредует H3k27me3 на промоторах антивирусных генов. Изучая такие связи в COVID-19, мы можем выявить новые терапевтические стратегии, например, перепрофилировать лекарства, уже находящиеся на продвинутой клинической стадии, для онкологических проявлений.
Это захватывающий пример того, как ChIP-опосредованная идентификация эпигеномных паттернов может играть роль в контроле механизмов противовирусного ответа в клетках. Освобождение этих недавно вытесненных меток может обеспечить несколько терапевтических подходов. См. Проект CEAT.
Пожалуйста, дайте обзор продуктовой линейки чипов Porvair Sciences и характеристик наборов чипов, которые помогают ученым проводить свои исследования.
Эпигенетический анализ сложен, и ChIP часто считается сложной техникой из-за узких мест в скорости и пропускной способности. В отличие от стандартных анализов ChIP на основе шариков, Chromatrap® использует уникальную систему на основе фильтров для захвата и селективного обогащения ДНК-связанных связывающих белков.
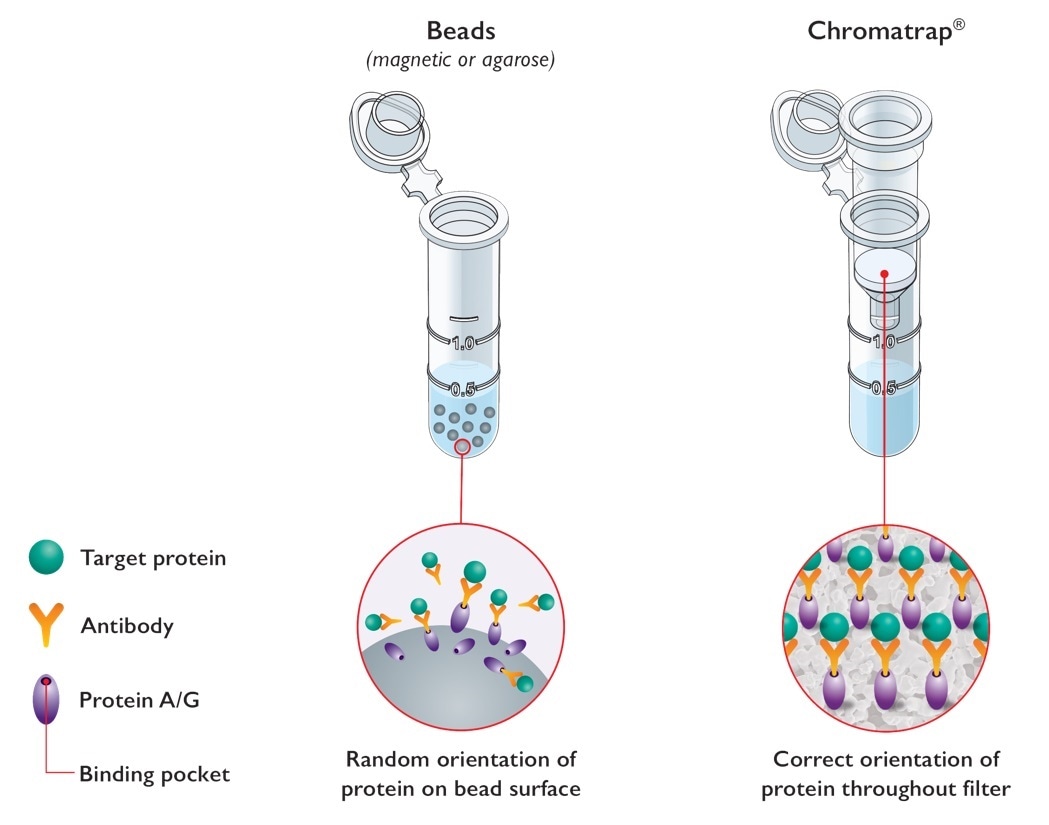
Изображение предоставлено: Porvair Sciences
Исключив шарики (магнитные и агарозные) из нашей технологии ChIP, мы смогли разработать анализ ChIP, который намного проще, быстрее, надежнее и, что самое главное, более чувствителен, чем стандартные анализы ChIP.
Предлагаемые как в формате центрифугированной спин-колонки, так и в 96-луночном планшете с высокой пропускной способностью, мы нацелены на эти узкие места, обеспечивая более простой, быстрый и более чувствительный чип. Формат Chromatrap ChIP с высокой пропускной способностью делает его идеальной системой для персонализированных медицинских приложений.
Каково будущее ChIP и изучения вирусной эпигенетики?
ChIP может играть важную роль в понимании роли эпигенетической регуляции в поддержании вирусных эписом посредством генерации хроматина, временного контроля транскрипции вирусных генов во время инфекции, регулирования латентности и переключения на литическую инфекцию, а также глобальное нарушение регуляции клеточной функции.
Понимая механизмы, с помощью которых вирусные патогены манипулируют хроматином хозяина, мы поймем новые аспекты вездесущих вирусов и прольем свет на ранее неизвестные аспекты биологии хроматина. Важно отметить, что, изучая молекулярные карты гистоновых меток, связанных с открытым и закрытым хроматином, мы можем нацеливаться на ферментные комплексы, рекрутируемые вирусом. Затем они становятся терапевтическими целями в попытках обратить эпигенетические изменения в геном хозяина.
Разработка специфических ингибиторов имеет огромный потенциал для новых классов противовирусных препаратов и открывает новые перспективы для новых подходов к сокращению или устранению латентных пулов вирусов. В настоящее время модельные системы ясно продемонстрировали потенциал этих подходов.
Однако необходимы согласованные усилия по распознаванию и внедрению этих подходов в клиническую терапию, с развитием технологии ChIP, используемой для отслеживания меток-мишеней и ферментных комплексов, а также мониторинга терапевтической эффективности и механизма.
Поскольку были достигнуты значительные успехи в разработке ингибиторов или других соединений, модулирующих хроматин для онкологии, следует четко распознавать и учитывать параллели модуляции хроматина при вирусных заболеваниях.
Воспаление и метаболизм – захватывающие возможности, основанные на опосредованной хроматином регуляции клеточного противовирусного ответа и контроле воспаления. Модуляция вирусной инфекции хроматином включает скоординированную научную оценку эпигеномов различных вирусных семейств.
Вероятно, что ChIP-анализы продолжат предоставлять наборы данных и базы данных по всему геному, фиксирующие состояние вирусного хроматина, что позволит лучше понять дополнительные регуляторные цепи в отношении различий между вирусными состояниями, зависимости от типа клеток и конкретных компонентов модуляции. . Затем интенсивные усилия позволят идентифицировать, изготовить или повторно использовать ряд соединений для нацеливания на эти регуляторные и распознающие компоненты хроматина в вирусологии.
Где читатели могут найти дополнительную информацию?
https://www.chromatrap.com/

О докторе Эми Джонсон
Д-р. Эми Джонсон руководит бизнесом и техническим развитием в Porvair Sciences. Вскоре после получения докторской степени по неврологии в Университете Суонси доктор Джонсон приступила к разработке технологии и ассортимента продукции Chromatrap для рынка эпигенетики. Вместе с ведущей группой ученых и инженеров д-р Джонсон продолжает заниматься разработкой новых технологий и решений для пробоподготовки и приложений в биологических науках.
О докторе Льюисе Фрэнсисе

Доктор Фрэнсис, доцент Университета Суонси, исследует клеточную гетерогенность в сложных тканевых микросредах. Исследование Льюиса направлено на выявление отдельных клеточных и молекулярных сетей для терапевтического воздействия, с акцентом на изучение экспрессии биомаркеров, сетей регуляции генов и взаимодействий между клетками и матриксами в тканевых пространствах ниш
.
 Диэнай
Диэнай