В исследовании, опубликованном в журнале PNAS сообщается о разработке наноразмерного и метастабильного оксида молибдена в качестве эффективного материала отрицательного электрода для водных электролитов в литий-ионных батареях. Ключевые результаты исследования – высокая плотность заряда, емкость и стабильность.
<img alt=" литий-ионные батареи "src =" https://d1otjdv2bf0507.cloudfront.net/images/news/ImageForNews_38289_16384603460258622.jpg "width =" 1000 "height =" 667 "/> [19459011
Исследование: Наноразмерные и метастабильные оксиды молибдена в качестве материалов отрицательных электродов для долговечных высокоэнергетических водных литий-ионных аккумуляторов. Изображение предоставлено: Smile Fight / Shutterstock.com
Перезаряжаемые батареи пользуются огромным спросом в связи с популярностью использования портативных устройств, таких как мобильные телефоны и ноутбуки, в электромобилях.
Обычно батарея состоит из двух электродов, анода (восстановитель) и катода (окислителя), которые разделены электролитом, переносящим ионный компонент химической реакции внутри элемента. Выходной сигнал батареи – это ток при определенном напряжении в течение времени, зависящего от накопленного заряда.
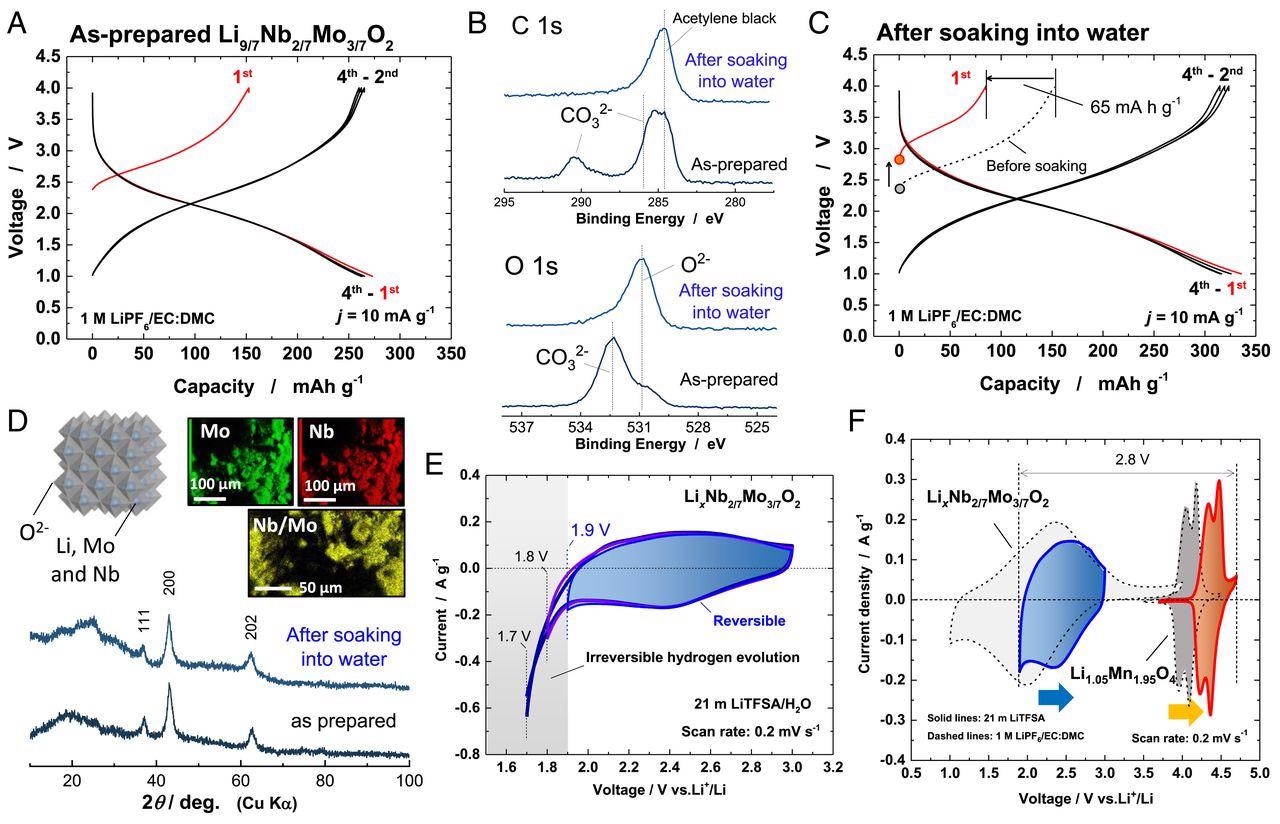
Характеристика Li x Nb 2/7 Mo ] 3/7 O 2 . ( A ) Кривые заряда / разряда (в неводной ячейке) предварительно приготовленного Li 9/7 ] Nb 2/7 Мо 3/7 O 2 . ( B ) Спектры SOXPES основных уровней C 1s и O 1s образца до и после погружения в воду. ( C ) Кривые заряда / разряда Li x Nb 2/7 Мо 3/7 O 2 после замачивания в воде. ( D ) Картины дифракции рентгеновских лучей (XRD) образца до и после замачивания в воде и элементные карты энергодисперсионной рентгеновской спектроскопии (EDX) образца после замачивания в воде. Схематическое изображение кристаллической структуры Li x Nb 2/7 Пн 3/7 O 2 нарисовано с помощью программы VESTA ( 33 ) также показано. (E ) Циклические вольтамперограммы Li x Nb 2 / 7 Мо 3/7 O 2 в 21 м LiTFSA со скоростью сканирования 0,2 мВ ⋅ с -1 . Синяя вертикальная линия показывает самый низкий предел потенциала, доступный для водного электролита LiTFSA 21 м. ( F ) Циклические вольтамперограммы Li 1,05 Mn 1,95 O 4 и Ли x Nb 2/7 Мо 3/7 O 2 в 21 м LiTFSA (сплошные линии) и 1 M LiPF 6 / EC: DMC (пунктирные линии) соответственно. Изображение предоставлено: Суо, Л. и др.
Литий-ионные батареи
В настоящее время литий-ионные батареи (LIB) считаются лучшими среди аккумуляторных батарей из-за их более высокой плотности энергии и эффективности.
LIB, используемые для электромобилей, имеют аккумуляторную мощность 50 кВтч, которая может обеспечить энергией поездку на 300 км. Более того, системам хранения энергии в масштабе энергосистемы требуется питание от батарей в диапазоне от мегаватт-часов до гигаватт-часов.
Однако из-за использования легковоспламеняющихся органических электролитов крупномасштабное производство LIB поднимает вопросы безопасности. Потенциальный метод решения этих проблем включает использование водных электролитов, которые имеют другие преимущества, такие как более высокая ионная проводимость и экологическая безопасность.
Использование водных электролитов приводит к небольшому количеству недостатков в LIB по сравнению с органическими электролитами, одним из которых является более низкая плотность энергии из-за низкого рабочего напряжения LIB с водными электролитами.
Это состояние возникает из-за медленной кинетики электролиза воды, что приводит к узкому диапазону электрохимической стабильности водных электролитов. Диапазон рабочего напряжения водных электролитов обычно составляет <1,8 В.
Есть много вариантов катодного материала, которые могут работать в окне стабильности водных электролитов; однако выбор отрицательного электролита ограничен. Кроме того, обычные анодные материалы демонстрируют реакции выделения водорода.
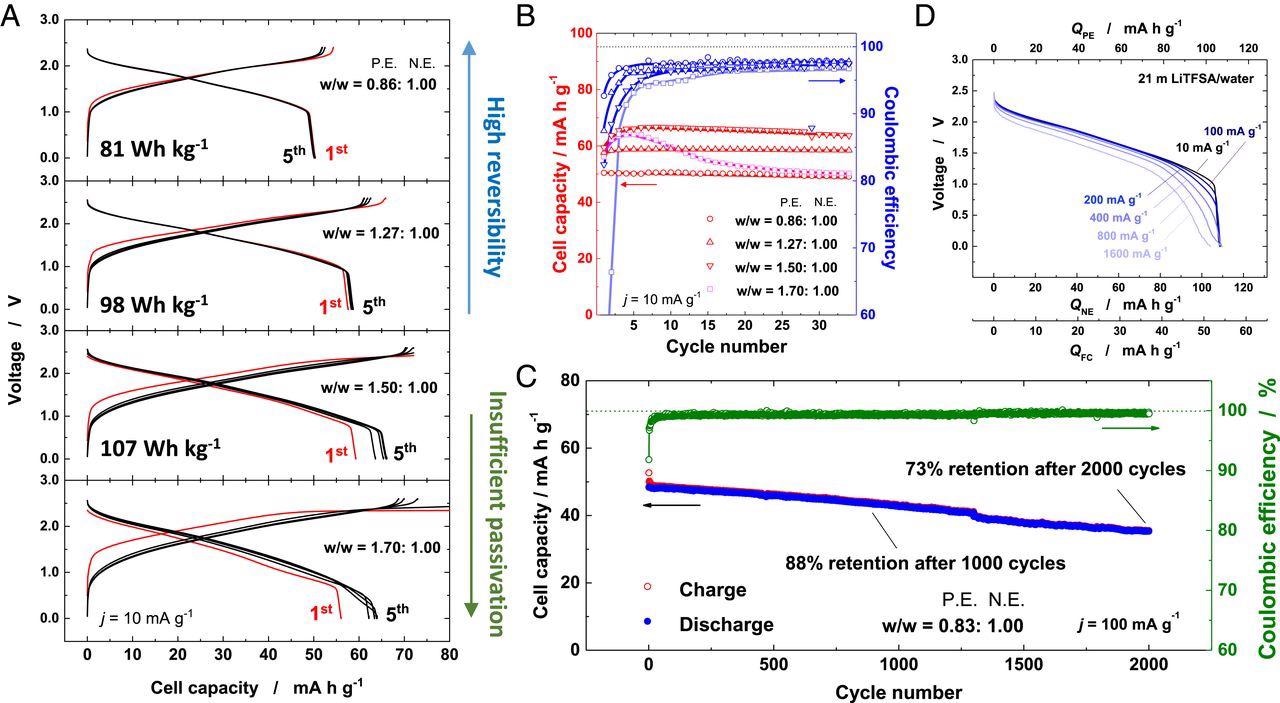
Электрохимические свойства Li 1,05 Mn 1,95 O 4 / Li x Nb 2/7 Мо 3/7 O 2 Полные клетки. ( A ) Сравнение кривых заряда / разряда Li 1,05 Mn 1,95 O 4 / Ли x Nb 2/7 Мо 3/7 O 2 полные ячейки, состоящие из различных весовых соотношений положительных электродов и отрицательных электродов со скоростью 10 мА ⋅ г -1 и ( B ) сохранение их емкости и кулоновская эффективность для 35 циклов на 21 м LiTFSA / H 2 O. ( C ) Долговременная стабильность работы полного элемента в течение 2000 циклов при 100 мА ⋅ g -1 и ( D ) скоростная способность полной ячейки в 21 м LiTFSA / H 2 О. Изображение предоставлено: Суо, Л. и др.
Вода в солевых электролитах для водных LIB
В 2015 году Суо и др. представили электролиты «вода в соли», которые демонстрируют более широкий интервал стабильности ~ 3 В. Один из примеров этого – насыщенные водные электролиты 21 М бис (трифторметансульфонил) амида лития (LiTFSA). Снижение концентрации воды привело к подавлению реакции выделения кислорода, что привело к более высокому потенциалу разложения при окислении.
Полная ячейка из LiMn 2 O 4 / Mo 6 S 8 в 21 M водном электролите LiFTSA сообщила о плотности энергии 84 Втч / кг -1 при скорости 0,2 ° C. Последнее исследование сообщает о плотности энергии 130 Вт · кг -1 для водных LIB, состоящих из Li 4 Ti 5 O 12 как материал отрицательного электрода.
Однако из-за неизбежной и одновременной реакции разложения молекул воды в электрохимических циклах высокая плотность энергии была достигнута только при более высоких скоростях. Более того, высокая скорость заряда и разряда ограничивала использование емкости отрицательного электрода до ~ 100 мА · ч. Г -1 .
Наноразмерный и метастабильный оксид молибдена в качестве материала отрицательного электрода
Настоящее исследование Юна и др. Сообщает о новом материале отрицательного электрода, который демонстрирует высокую емкость и высокую долговечность в водных LIB. Электрод из литиевого избыточного оксида молибдена, содержащий ионы ниобия, Li 9/7 Nb 2/7 Mo 3/7 O 2 был синтезирован путем механического измельчения LiMoO 2 и Li 3 NbO 4 . Ранее было доказано, что механическое измельчение позволяет синтезировать эффективные метастабильные материалы.
Из-за окисления материала при контакте с влагой сообщалось о дефектах в объеме материала и о присутствии LiOH на поверхности оксидных частиц. Химический анализ поверхности материала до и после замачивания в воде был изучен и дополнительно проанализирован.
Материал показал присутствие Li 2 CO 3 перед замачиванием в воде, что указывает на адсорбцию газа CO 2 LiOH. Анализ материала после замачивания в воде показал удаление LiCO 3 и дальнейшее окисление оксидов молибдена
.
Это окисление оксида молибдена было зарегистрировано полезным при использовании в качестве материала отрицательного электрода. LiCO 3 растворяется в воде, и сообщается о более чистой поверхности от оксидных частиц.
Однако не сообщалось о каких-либо значительных изменениях кристаллической структуры даже после вымачивания в воде. Материал сохранил катионно-неупорядоченную структуру каменной соли после замачивания в воде с небольшим изменением параметров решетки.
Энергодисперсионная рентгеновская элементная карта прояснила равномерное распределение ионов Nd и Mo в материале, что указывало на то, что ионы Li извлекались из оксидов топотактическим способом.
Li x Nd 2/7 Mo 3/7 O 2 (избыточное метастабильное состояние Li) был исследован на предмет обнаружения производительность и стабильность электрода по данным циклической вольтамперометрии (ЦВА) в водном растворе 21 M электролита LiTFSA. Результаты показали высокую емкость и стабильность при длительном сроке службы для водных систем.
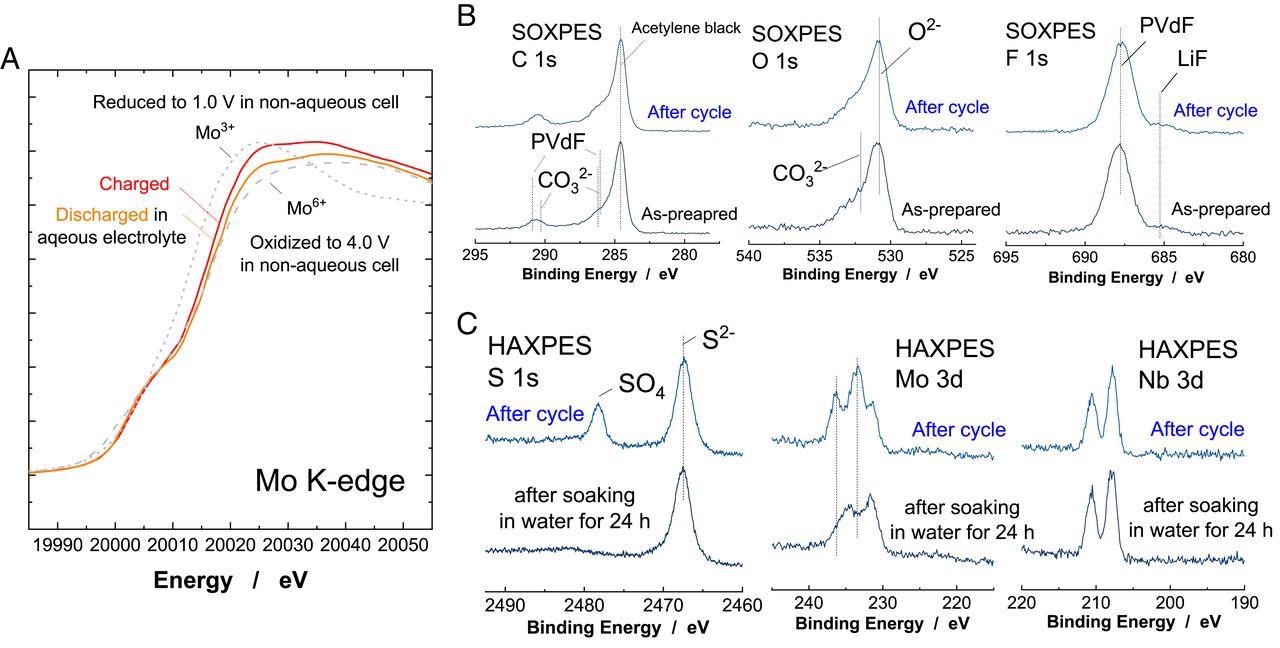
Характеристика Li x Nb 2/7 Mo ] 3/7 O 2 циклически в водном электролите. ( A ) Изменения в спектрах XAS Mo K-края Li x Nb 2/7 Мо 3/7 O 2 после цикла в водном электролите (отношение массы положительного электрода к отрицательному электроду было установлено равным 1,0). Данные, собранные в неводном электролите, также показаны для сравнения. ( B ) Спектры SOXPES композитного Li x Nb 2/7 Мо 3/7 O 2 электроды до и после цикла 21 м LiTFSA / H 2 O. Полная ячейка проверялась в диапазоне от 0 до 2,6 В в течение пяти циклов со скоростью 10 мА ⋅ g -1 (коэффициент нагрузки 1,5), а затем отрицательный электрод вынули из ячейки для измерения. (C) Спектры HAXPES циклического электрода после ополаскивания водой в течение короткого времени (обозначается как «после цикла») и после замачивания в воде в течение 24 часов. Другие наборы данных можно найти в приложении SI рис. S12 . Изображение предоставлено: Суо, Л. и др.
Защитный пассивирующий слой над Li x Nd 2/7 Mo 3/7 O 2 наблюдался после цикла в 21 M LiTFSA, который показал эффективное подавление реакции выделения водорода. Этот поверхностный слой образовался в результате разложения использованного электролита, что еще больше увеличило доступную емкость Li x Nd 2/7 Mo 3/7 O 2 .
Оптимизированные водные LIB показали высокую плотность энергии 107 Вт · кг -1 даже при низкой скорости. Кроме того, сообщалось о высокой долговечности – ~ 73% сохранения емкости в течение более 2000 циклов при 100 мА · г -1 с полной ячейкой.
Предмет исследования в будущем
Это исследование показало Li x Nd 2/7 Mo 3/7 O 2 как эффективный материал отрицательного электрода для водной литий-ионные аккумуляторы, обладающие высокой плотностью заряда и емкостью. Результаты вносят вклад в разработку безопасных и прочных водных LIB и указывают на возможности разработки материалов для улучшения характеристик водных литий-ионных батарей.
Ссылка
Юн, Дж., Сагехаши, Р., Сато, Ю., Масуда, Т., Хосино, С., Раджендра, Х. Б., Окуно, К., Хосоэ, А., Бандаренка, А.С. и Ябуучи, Н. (2021) Наноразмерные и метастабильные оксиды молибдена в качестве материалов отрицательных электродов для долговечных высокоэнергетических водных литий-ионных аккумуляторов. Proceedings of the National Academy of Sciences 118 (48). Доступно по адресу: https://nanoscalereslett.springeropen.com/articles/10.1186/s11671-021-03613-z
Дополнительная литература
Суо, Л., Бородин, О., Гао, Т., Ольгин, М., Хо, Дж., Фань, X., Луо, К., Ван, К., Сюй, К. (2015) Электролит «вода в соли» позволяет получать высоковольтные водные литий-ионные химические соединения. Science 350 (6263), pp.938-943. Доступно по адресу: https://doi.org/10.1126/science.aab1595.
Гуденаф, Дж. Б. и Парк, К. С. (2013) Литий-ионная аккумуляторная батарея: перспектива. Журнал Американского химического общества 135 (4), стр.1167-1176. Доступно по адресу: https://doi.org/10.1021/ja3091438.[19459007provided
 Диэнай
Диэнай