Корпорация Promega сегодня объявила о том, что она вступила в глобальное сотрудничество с Merck, известной как MSD за пределами США и Канады, с целью разработки технологии микросателлитной нестабильности (MSI) Promega в качестве фирменной диагностики сопутствующих опухолей (CDx) для использовать с терапией Merck против PD-1, KEYTRUDA ® (пембролизумаб). Первоначально глобальное сотрудничество будет запрашивать нормативное одобрение CDX Promega MSI в Соединенных Штатах и Китае. Планы по поиску разрешений на дополнительных территориях могут последовать.
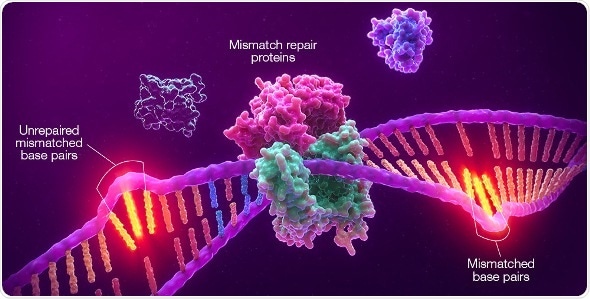
Корпорация Promega вступила в глобальное сотрудничество с Merck, известной как MSD за пределами США и Канады, с целью разработки технологии микросателлитной нестабильности (MSI) Promega в качестве сопутствующей диагностической диагностики солидных опухолей (CDx) для использовать с терапией Merck против PD-1, KEYTRUDA ® (пембролизумаб). Выше приведена иллюстрация MSI, демонстрирующая невосстановленные несоответствия в микросателлитных областях, возникающие в результате дефицита в системе исправления несоответствия (dMMR). (Графика: Business Wire)
«Отрадно, что наша технология MSI имеет такое значение в онкологическом сообществе», – сказал Билл Линтон, президент и исполнительный директор Promega Corporation. «Promega разработала эту технологию более десяти лет назад, и наша многолетняя приверженность исследованиям и разработкам помогла развить ее использование».
Технология Promega MSI была проверена в лабораториях по всему миру для характеристики статуса MSI солидной опухоли. Тестирование MSI функционально измеряет накопление геномных ошибок вставки или удаления (INDEL), вызванных недостаточной системой исправления несоответствия (dMMR), которая возникает при определенных типах солидных опухолей, и этот скрининг может использоваться для лучшей характеристики опухолей и определения терапевтического выбора для MSI-Высокие типы рака. Было показано, что опухоли со статусом MSI-High реагируют на терапию ингибиторами иммунной контрольной точки (ICI). Этот результат может быть объяснен MSI-управляемой экспрессией опухолей ассоциированных с мутациями неоантигенов (MANA), которые, как полагают, вызывают инфильтрацию иммунных клеток в микроокружение опухоли. Индуцированное опухолью ингибирование активности иммунных клеток можно преодолеть с помощью терапии ICI, позволяющей разрушать опухолевые клетки иммунными клетками.
В отличие от других вариантов молекулярного скрининга на основе ДНК, технология Promega MSI использует пять мономорфных мононуклеотидов, что рекомендовано Национальным институтом рака. Наш тест использует чувствительную и специфическую группу маркеров для определения статуса MSI и предлагает ценную информацию, чтобы помочь информировать врачей о том, как лучше всего лечить пациентов с раком, включая тех, которые, вероятно, выиграют от лечения ингибитором иммунной контрольной точки ».
Джефф Бачер, доктор философии, старший научный сотрудник, Promega Corporation
Технология Promega MSI является одним из ведущих стандартных тестов для определения статуса MSI в исследовательских лабораториях и недавно достигла статуса инноваций и обзора приоритетов Национальной администрацией по медицинским продуктам (NMPA) в Китае. Он широко использовался в клинических исследованиях более 15 лет и поддерживается более чем 140 рецензируемыми публикациями. Promega продолжает продвигать перспективы технологии MSI во всем мире. В дополнение к объявлению о сотрудничестве Merck, Promega намерена добиваться нормативного разрешения для диагностического (IVD) теста MSI in vitro в США, Китае и Европе. Эти продукты предназначены для запуска в первой половине 2020 года в Соединенных Штатах, Китае и Европе.
 Диэнай
Диэнай